
【题目】SO2广泛用于医药、硫酸工业等领域,回收废气中的SO2可用如下方法。
方法Ⅰ | 用碱式硫酸铝Al2(SO4)x(OH)y溶液吸收富集SO2 |
方法Ⅱ | 在Fe2+或Fe3+催化下,用空气(O2)将SO2氧化为H2SO4 |
(1)方法Ⅰ的过程如下。
① 制备Al2(SO4)x(OH)y
向Al2(SO4)3溶液中加入CaO粉末,调pH至3.6。 CaO的作用之一是促进_______水解(填离子符号,下同),二是沉淀一部分_______。
② 吸收:Al2(SO4)x(OH)y吸收SO2后的产物是_______(写化学式)。
③ 解吸:加热②中产物,产生SO2,Al2(SO4)x(OH)y再生。
(2)方法Ⅱ中,在Fe2+催化下,SO2、O2和H2O生成H2SO4的化学方程式是______。
(3)方法Ⅱ中,Fe2+的催化过程可表示如下:
ⅰ:2 Fe2++ SO2+ O2=2 Fe3++ SO42-
ⅱ: ……
① 写出ⅱ的离子方程式:______。
② 下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向FeCl2溶液滴入KSCN,无变化
b.向FeCl2溶液通入少量SO2,滴入KSCN,颜色变红。
c.取b中溶液,_______。
(4)方法Ⅱ中,催化氧化后,采用滴定法测定废气中残留SO2的含量。将V L(已换算为标准状况)废气中的SO2用1%的H2O2完全吸收,吸收液用下图所示装置滴定,共消耗a mL c mol/L NaOH标准液。
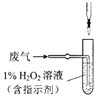
① H2O2氧化SO2的化学方程式_______。
② 废气中残留SO2的体积分数为_______。
【答案】 ![]()
![]()
![]()
![]()
![]()
![]()
![]() 通入
通入![]() ,溶液红色褪去(或变浅)
,溶液红色褪去(或变浅) ![]()
![]()
【解析】(1)①向Al2(SO4)3溶液中加入CaO粉末,氧化钙与水反应生成氢氧化钙,氢氧化钙中和了铝离子水解生成的氢离子,促进铝离子水解,同时生成微溶于水的硫酸钙沉淀,故答案为:![]() ;
; ![]() ;
;
②Al2(SO4)x(OH)y 与二氧化硫反应时,本质为氢氧根离子与二氧化硫反应,生成亚硫酸根离子,因此Al2(SO4)x(OH)y吸收SO2后的产物为![]() ,故答案为:
,故答案为:![]() ;
;
(2)方法Ⅱ中,在Fe2+催化下,SO2、O2和H2O生成H2SO4的化学方程式为![]()
![]()
![]() ,故答案为:
,故答案为:![]()
![]()
![]() ;
;
(3)① 根据总反应![]()
![]()
![]() ,用正反应-反应i(2 Fe2++ SO2+ O2=2 Fe3++ SO42-)得:ⅱ的离子方程式为
,用正反应-反应i(2 Fe2++ SO2+ O2=2 Fe3++ SO42-)得:ⅱ的离子方程式为![]() ,故答案为:
,故答案为:![]() ;
;
②a.向FeCl2溶液滴入KSCN,无变化,说明不存在Fe3+,b.向FeCl2溶液通入少量SO2,滴入KSCN,颜色变红,说明生成了Fe3+,c.取b中溶液,再通入![]() ,溶液红色褪去,说明Fe3+被二氧化硫还原生成了Fe2+,说明在反应过程中Fe2+是催化剂,故答案为:通入
,溶液红色褪去,说明Fe3+被二氧化硫还原生成了Fe2+,说明在反应过程中Fe2+是催化剂,故答案为:通入![]() ,溶液红色褪去;
,溶液红色褪去;
(4)① H2O2氧化SO2反应生成硫酸,反应的化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
②氢氧化钠的物质的量=ac×10-3mol,说明生成的硫酸为![]() ×ac×10-3mol,废气中含有的二氧化硫为
×ac×10-3mol,废气中含有的二氧化硫为![]() ×ac×10-3mol,废气中残留SO2的体积分数=
×ac×10-3mol,废气中残留SO2的体积分数=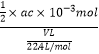 ×100%=
×100%=![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。下列说法不正确的是

A. 因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀
B. 若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小
C. 铜极上的反应是2H+ + 2e- = H2↑,O2 + 4e-+ 4H+ = 2H2O
D. 在金属表面涂一层油脂,能防止铁铆钉被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氧化性: Cl2>Br2>Fe3+>I2,则下列离子方程式正确的是:
A. 少量氯气与FeBr2溶液反应Cl2+2Br-=2C1-+Br2
B. 过量氯气与FeBr2溶液反应Cl2+Fe2++2Br-=2Cl-+Br2+Fe3+
C. 氯气与FeBr2溶液以物质的量1:1反应2Cl2+2Fe2++2Br-=4Cl-+Br2+2Fe3+
D. 少量氯气与FeI2溶液反应Cl2+2Fe2+=2Cl-+2Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列实验装置图,按要求作答:

(1)装置中c、d、e的名称分别为____________、____________、____________。
(2)分离下列物质,需要在哪套装置中进行?
Ⅰ.干燥H2,可采用_______(填装置序号)装置。
Ⅱ. 分离碘水中的碘应先选择装置_____(填装置序号)进行_______和_______操作。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氟酸是一种弱酸,可用来刻蚀玻璃,已知25℃时:
HF(aq) + OH—(aq)![]() F—(aq) + H2O(l) △H=-67.7 kJ/mol
F—(aq) + H2O(l) △H=-67.7 kJ/mol
H+(aq) + OH—(aq)![]() H2O(l) △H=-57.3kJ/mol
H2O(l) △H=-57.3kJ/mol
在10 mL 0.1mol/L的NaOH溶液中,加入10 mL 浓度为c mol/L的HF稀溶液,下列说法中错误的是
A. 当氢氟酸溶液温度升高,HF的电离程度减小(不考虑挥发)
B. 水电离的热化学方程式为:H2O(1)![]() H+(aq)+OH—(aq);△H= +57.3kJ/mol
H+(aq)+OH—(aq);△H= +57.3kJ/mol
C. 当c > 0.1时,一定不存在:c(Na+) = c(F—)
D. 若混合后溶液中:c(Na+)>c(OH—) >c(F—)>c(H+),则c一定小于0.1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱是厨房里的常见物质,请写出纯碱的化学式________,若食盐中可能混入了少量纯碱,用下列厨房中的哪种物质可进行检验________。
A.白酒 B.食醋 C.酱油 D.白糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是298 K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是

A. 该反应的热化学方程式为:N2+3H2![]() 2NH3 △H=-92 kJ/mol
2NH3 △H=-92 kJ/mol
B. a曲线是加入催化剂时的能量变化曲线
C. 加入催化剂,该化学反应的反应热不改变
D. 在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为92kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是
A. W2-、X+ B. X+、Y3+
C. Y3+、Z2- D. X+、Z2-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com