
【题目】空气污染问题日益引起全民关注.
(1)PM2.5是指大气中直径小于或等于2.5μm(1μm=103nm)的颗粒物.下列说法不正确的是(填字母序号).
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(2)北京科研工作者用五年时间研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4和Ca(NO2)2 . 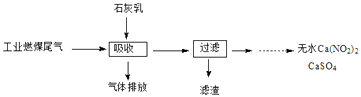
①硫酸型酸雨的形成过程是大气中的SO2溶于雨水生成某种弱酸,在空气中经催化氧化生成硫酸,该过程中反应的化学方程式为、 .
②CaSO4可以调节水泥的硬化时间.尾气中SO2与石灰乳反应生成CaSO4的化学方程式为 .
③Ca(NO2)2可制成混凝土防冻剂、钢筋阻锈剂等.尾气中NO、NO2与石灰乳反应生成Ca(NO2)2的化学方程式 .
【答案】
(1)bc;bc
(2)SO2+H2O?H2SO3;2H2SO3+O2═2H2SO4;2SO2+O2+2Ca(OH)2═2CaSO4+2H2O;NO+NO2+Ca(OH)2═Ca(NO2)2+H2O
【解析】解:(1)a.PM2.5是指大气中直径小于或等于2.5μm的颗粒物.它的主要来源是日常发电、工业生产、汽车尾气排放等过程中经过燃烧而排放的残留物,故a正确;
b.PM2.5表面积大,具有吸附性,能吸附大量有毒物质,故b错误;
c.胶体微粒直径在10﹣7m~10﹣9m之间,PM2.5粒子的大小不符合,故c错误;
d.减少机动车尾气排放,减少了烟尘,能降低空气中PM2.5,故d正确;
故选:bc;(2)①硫酸型酸雨形成过程是SO2溶于水生成亚硫酸,SO2+H2OH2SO3;再被空气中的氧气氧化成硫酸,2H2SO3+O2═2H2SO4 ,
所以答案是:SO2+H2OH2SO3 , 2H2SO3+O2═2H2SO4;
②尾气中SO2与氧气和石灰乳反应生成CaSO4和水,反应方程式为:2SO2+O2+2Ca(OH)2═2CaSO4+2H2O所以答案是:2SO2+O2+2Ca(OH)2═2CaSO4+2H2O;
③尾气中NO、NO2与石灰乳反应生成Ca(NO2)2和水,反应方程式为NO+NO2+Ca(OH)2═Ca(NO2)2+H2O;所以答案是:NO+NO2+Ca(OH)2═Ca(NO2)2+H2O.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
【题目】下列实验能获得成功的是( )
A.用溴水可鉴别苯、CCl4、己烯
B.加浓溴水,然后过滤可除去苯中少量己烯
C.苯、溴水、铁粉混合制成溴苯
D.可用分液漏斗分离己烷和苯的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,表为制取Cu2O的三种方法:
方法Ⅰ | 用炭粉在高温条件下还原CuO |
方法Ⅱ | 电解法:2Cu+H2O |
方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法II和方法III制取Cu2O而很少用方法I,其原因是 .
(2)己知:2Cu(s)+ ![]() O2(g)=Cu2O(s)△H=﹣akJmol﹣1C(s)+
O2(g)=Cu2O(s)△H=﹣akJmol﹣1C(s)+ ![]() O2(g)=CO(s)△H=﹣bkJmol﹣1
O2(g)=CO(s)△H=﹣bkJmol﹣1
Cu(s)+ ![]() O2(g)=CuO(s)△H=﹣ckJmol﹣1
O2(g)=CuO(s)△H=﹣ckJmol﹣1
则方法I发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=kJmol﹣1 .
(3)方法II采用离子交换膜控制电解液中OH﹣的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为 .
(4)方法III为加热条件下用液态拼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2 . 该制法的化学方程式为 .
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验: 2H2O(g) ![]() 2H2(g)+O2(g)△H>0
2H2(g)+O2(g)△H>0
水蒸气的浓度随时间t变化如表所示.
序号 | 0 | 10 | 20 | 30 | 40 | 50 | |
① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
下列叙述正确的是(填字母代号).
A.实验温度:T1<T2
B.实验①前20min的平均反应速率v(O2)=7×10﹣5mol/(Lmin)
C.实验②比实验①所用的催化剂效率高
(6)25℃时,向50mL0.018mol/L的AgNO3溶液中加入50mL0.02mol/L盐酸,生成沉淀.若已知Ksp(AgCl)=1.8×10﹣10 , 则此时溶液中的c(Ag+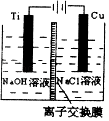
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物与生产、生活关系密切.t℃时,反应FeO(s)+CO(g)Fe(s)+CO2(g)的平衡常数K=0.25,反应达到平衡时n(CO):n(CO2)= . 若在1L密闭容器中加入0.02mol FeO(s),并通入xmolCO,t℃时反应达到平衡.此时FeO(s)转化率为50%,则x= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学实验小组将6mol A和 8mol B 充入2L的密闭容器中,某温度下,发生的反应为A(g)+3B(g)C(g)+D(g)△H=﹣49.0 kJmol﹣1 . 测得B的物质的量随时间变化的关系如图所示(实线). 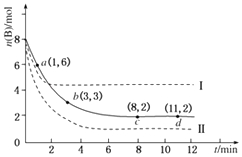
(1)下列时间段A的平均反应速率最大的是(填选项字母,下同),最小的是 .
A.0~1min B.1~3min C.3~8min D.8~11min
(2)b点的正反应速率(填“大于”“等于”或“小于”)逆反应速率.
(3)平衡时B的转化率为 , 该温度下的化学平衡常数K= .
(4)仅改变某一实验条件再进行两次实验,测得B的物质的量随时间变化如图中虚线所示.则曲线Ⅰ改变的条件是 , 曲线Ⅱ改变的条件是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示.下列推断正确的是( ) 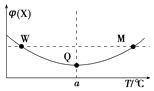
A.升高温度,平衡常数减小
B.W,M两点Y的正反应速率相等
C.平衡后充入Z达到新平衡时Z的体积分数增大
D.M点时,Y的转化率最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C三种不溶于水的固体。A是某元素的一种单质,它在氧气中完全燃烧得到一种无色气体,此气体能使澄清的石灰水变浑浊,另外测得这种气体密度为同温、同压下的氧气密度的1.375倍。B固体能溶于热苛性钠溶液,再往所得的溶液中加入过量盐酸时,析出白色胶状沉淀。此沉淀干燥后,成为不溶于水的白色粉末,这是一种比碳酸酸性还弱的酸。将B与石灰石、纯碱按比例混合加热后能得到C,C在高温时软化,无固定熔点。
根据以上事实,判断A为元素的单质,B的化学式为 , C物质为。
写出生成C的有关反应的化学方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)3.6 g H2O的物质的量是________,含有____________________________个水分子,含有________mol H。
(2)11.7 g NaCl的物质的量是________,含有____________个Na+,________________个
Cl-,共含离子________mol。
(3)3.01×1022个OH-的物质的量为________,质量为________,含有质子的物质的量为________,含有电子的物质的量为________,这些OH-与________mol NH3的质量相同,和________g Na+含有的离子数相同。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com