
【题目】(1)、按要求填空:
①、第三周期中有两个成单电子的元素符号是__________。
②、四核10电子的粒子的电子式(写一种)__________。
③、第四周期中,3d轨道半充满的元素符号是__________。
(2)、写出符合下列条件的元素原子的电子排布式:
①、自然界中含量居第二的金属元素__________。
②、第四周期0族元素__________。
③、能形成自然界中最硬的单质的元素__________。
【答案】 Si、S 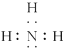 Cr、Mn 1s22s22p63s23p63d64s2 1s22s22p63s23p63d104s24p6 1s22s22p2
Cr、Mn 1s22s22p63s23p63d64s2 1s22s22p63s23p63d104s24p6 1s22s22p2
【解析】
(1)①第三周期中,有两个成单电子,外围电子排布为3s23p2或3s23p4;②四核10电子粒子中含4个原子、电子数为10;③第四周期元素中,4p轨道半充满说明4p轨道中含有3个电子,3d轨道半充满说明3d轨道中含有5个电子;(2)处于最低能量的原子叫做基态原子,基态电子排布遵循能量最低原理、保里不相容原理和洪特规则,根据元素符号,判断元素原子的核外电子数,再根据核外电子排布规律来写,以此解答该题。
(1)①第三周期中,有两个成单电子,外围电子排布为3s23p2或3s23p4,所以为Si、S;②四核10电子粒子中含4个原子、电子数为10,符合条件的有NH3、H3O+,氨气的电子式为: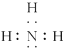 ;③3d轨道半充满说明3d轨道中含有5个电子,根据电子排布规则知,该原子的4s能级上电子全满或半充满,所以该基态原子的核外电子排布式为:[Ar]3d54s1或[Ar]3d54s2,所以为Cr和Mn;(2)①自然界中含量居第二的金属元素为铁,电子排布式为1s22s22p63s23p63d64s2;②第四周期0族元素为Kr,电子排布式为1s22s22p63s23p63d104s24p6;③能形成自然界中最硬的单质的元素为碳,电子排布式为1s22s22p2。
;③3d轨道半充满说明3d轨道中含有5个电子,根据电子排布规则知,该原子的4s能级上电子全满或半充满,所以该基态原子的核外电子排布式为:[Ar]3d54s1或[Ar]3d54s2,所以为Cr和Mn;(2)①自然界中含量居第二的金属元素为铁,电子排布式为1s22s22p63s23p63d64s2;②第四周期0族元素为Kr,电子排布式为1s22s22p63s23p63d104s24p6;③能形成自然界中最硬的单质的元素为碳,电子排布式为1s22s22p2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要意义。对于密闭容器中的反应:N2(g)+3H2(g)![]() 2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是
2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是

A. 点a的正反应速率比点b的小
B. 点c处反应达到平衡
C. 点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D. 点e处反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知NO2和N2O4之间发生可逆反应:2NO2(g)(红棕色)![]() N2O4(g)(无色)
N2O4(g)(无色)
(1)在烧瓶A和B中盛有相同浓度的NO2与N2O4的混合气体,中间用止水夹夹紧,浸入到盛有水的烧杯中,如图所示。

分别向两个烧杯中加入浓硫酸和NH4NO3固体,观察到的现象是:A中气体红棕色加深,B中____。这说明,当条件改变时,原来的化学平衡将被破坏,并在新的条件下建立起新的平衡,即发生_____。
(2)如图是在一定温度下,某固定容积的密闭容器中充入一定量的NO2气体后,反应速率(v)与时间(t)的关系曲线。下列叙述正确的是______。
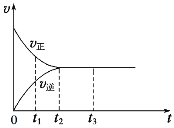
a.t1时,反应未达到平衡, NO2浓度在减小
b.t2时,反应达到平衡,反应不再进行
c.t2~t3,各物质浓度不再变化
d.t2~t3,各物质的浓度相等
e.0~t2,N2O4浓度增大
f.反应过程中气体的颜色不变
Ⅱ.某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:
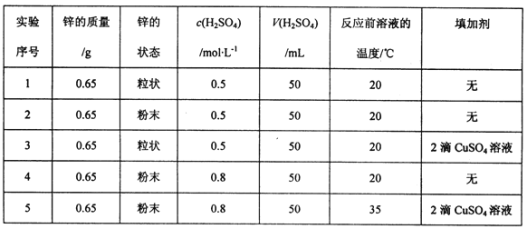
(1)在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过定量测定锌完全消失所需的时间进行判断,其速率最快的实验是_____(填实验序号)。
(2)对锌和稀硫酸反应,实验1和2表明,____对反应速率有影响。
(3)进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间t的图像如图所示。
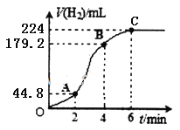
在OA、AB、BC三段中反应速率最快的是__,2~4min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医用麻醉药苄佐卡因E和食品防腐剂J的合成路线如下:
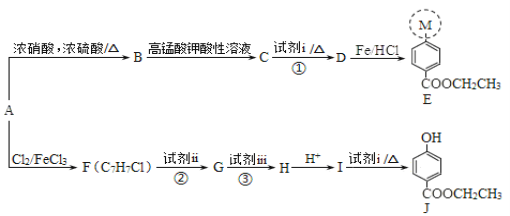
已知:I.M代表E分子结构中的一部分
II.![]()
请回答下列问题:
(1)A属于芳香烃,分子式为C7H8 ,其名称是_______,A到B的反应类型是______________________。
(2)E中所含含氧官能团的名称是_______,M的结构简式是__________。
(3)C能与NaHCO3溶液反应,则反应①的化学方程式是_____________。
(4)反应②、③中试剂ii和试剂iii依次是_______。(填序号)
a.高锰酸钾酸性溶液、氢氧化钠溶液
b.氢氧化钠溶液、高锰酸钾酸性溶液
(5)H的结构简式是_______。
(6)J有多种同分异构体,其中符合下列条件的同分异构体有______ 种,写出其中任一种同分异构体的结构简式:____。
a.为苯的二元取代物
b.遇到FeCl3溶液显紫色,能发生水解反应且能发生银镜反应
(7)以A为起始原料,选用必要的无机试剂合成涂改液的主要成分亚甲基环己烷(![]() ),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭 头上注明试剂和反应条件):_____________
),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭 头上注明试剂和反应条件):_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)性能优越,被称为继铁、铝后的“第三金属”。工业上以金红石为原料制取Ti的反应为 : aTiO2+bCl2+cC![]() aTiCl4+cCO 反应(1)
aTiCl4+cCO 反应(1)
TiCl4+2Mg![]() Ti+2MgCl2 反应(2)
Ti+2MgCl2 反应(2)
关于反应(1)、(2)的分析不正确的是( )
①TiCl4在反应(1)中是还原产物,在反应(2)中是氧化剂;
②C、Mg在反应中均为还原剂,被还原;
③在反应(1)、(2)中的还原性C>TiCl4,Mg>Ti;
④a=1,b=c=2;
⑤每生成19.2 g Ti(Ar=48),反应(1)、(2)中共转移4.8 mol e-。
A. 仅② B. ②③④ C. ③④ D. ②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中最终可以得到Al(OH)3的是( )
A. Al2O3和水混合加热 B. Al和水反应
C. 过量的NaOH溶液加入到AlCl3溶液中 D. 过量的氨气通入到AlCl3溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人说:“Na2O2脾气火爆,一见二氧化碳就变脸, 遇见水就生气”。这种说法引起了某学习小组的兴趣,于是对Na2O2性质进行以下实验探究。
完成下列填空:
(1)实验装置如图所示。挤压胶头滴管,预期看到的实验现象________________、__________(写出2条主要现象)。
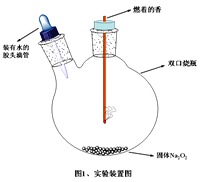
(2)写出Na2O2遇CO2“变脸”的化学方程式____________。若Na2O2长期露置于空气中,最终会转化为_________(填物质名称)。
(3)某同学发现Na2O2见水“生气”后所得溶液温度升高,滴加酚酞试液,酚酞先变红,但很快就褪色。对此设计实验进行探究:取两支试管分别加入少量Na2O2粉末,一支冰水浴,一支热水浴,两支试管里都滴加蒸馏水和酚酞。该实验的目的是__________________________。另一同学将实验改为:取两支试管,分别加入滴有酚酞的红色NaOH溶液,一支冰水浴,一支热水浴。你认为改后能否达到原实验目的____________,理由_______________________________。
(4)根据Na2O2的性质,指出它的一种用途_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家屠呦呦因成功提取青蒿素而获得2015年诺贝尔生理学或医学奖。研究团队发现在温度较高时未能提取到青蒿素,最终确认只有采用低温、乙醚冷浸等方法才能成功提取青蒿素。下面反应是青蒿素在一定条件下转化为双氢青蒿素:

以下说法不正确的是( )
A. 较高温度下未能提取到青蒿素的原因与分子中存在非极性的O—O键的不稳定性有关
B. 青蒿素和双氢青蒿素均能使湿润的淀粉-碘化钾试纸变蓝色
C. 双氢青蒿素比青蒿素的水溶性好,所以治疗疟疾的效果更好
D. 青蒿素属于酯类化合物,分子中碳原子采用sp3杂化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com