
【题目】“保护环境”是我国的基本国策,下列做法应该提倡的是( )
A.燃烧含硫燃料B.垃圾分类回收C.露天焚烧秸秆D.污水排入河流
 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)可用于汽车安全气囊的添加剂,与酸反应生成N2和H2。某学习小组在实验室用亚硝酸钠和氨在无氧环境中制备NaN3,设计如下实验(夹持装置略去):

(1)按气流从左到右的方向,上述装置合理的连接顺序为_________________(填仪器接口字母)。
(2)试剂X可选用________________(填试剂名称)。
(3)装置C中发生反应的化学方程式为_________________________________________,该反应需要在无氧环境中进行的原因为_______________________________________________。
(4)装置B的作用为___________________________________________。
(5)加热条件下,NaNH2和N2O反应也可制备NaN3,同时生成能使湿响的红色石蕊试纸变蓝的气体,该反应的化学方程式为_____________________________________________。
(6)HNO2是一元弱酸,不稳定,容易分解为两种氮的氧化物。现用如下试剂:NaNO2、pH试纸、水、稀硫酸、NaOH溶液、碱石灰、CuSO4、CuO,计实验证明((可加热);
①HNO2为弱酸:____________________________________________________。
②装置C中反应进行一段时间后,有NaN3生成:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定物质的量浓度的盐酸和醋酸中分别加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示.根据图判断下列说法正确的是( )

A. 曲线Ⅱ为醋酸稀释时的变化曲线
B. a、b、c三点溶液的pH大小顺序为a>b>c
C. a点的Kw值比b点的Kw值大
D. b点水电离的H+物质的量浓度小于c点水电离的H+物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+Br2(l)=2HBr(g) H=-akJ/mol,蒸发1molBr2(l)需要吸收的能量为30kJ,其他数据如下表:
H2(g) | Br2(g) | HBr(g) | |
1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | b | 369 |
下列说法正确的是
A. 2HBr(g)=H2(g)+Br2(g)H=+akJ/mol
B. H2(g)的稳定性低于HBr(g)
C. Br2(g)=Br2(l) H=+30kJ/mol
D. b=272-a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿[Fe(CrO2)2]为原料可制备K2Cr2O7和金属铬。实验流程如下:
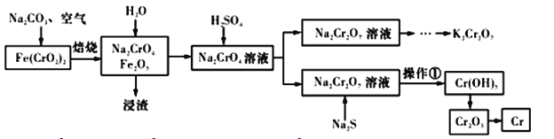
已知:2CrO42-+2H+=Cr2O72-+H2O。pH<3.0,CrO42-含量极小。
(1)写出铬铁矿焙烧转化为Na2CrO4的化学反应方程式:_____________________________________;焙烧时不能使用陶瓷容器的原因是________________________________________。
(2)加入稀硫酸后所得Na2Cr2O7溶液的pH应小于3.0,可用_________________测定溶液pH。
(3)操作①包括过滤和洗涤。实验室洗涤沉淀的操作是________________________________。
(4)Na2S的作用是①__________________________和②___________________________。
(5)Fe3+在pH为3.7时可完全转化为Fe(OH)3。在上述流程中所得Na2Cr2O7溶液中含有少量Fe3+。请结合下图有关物质的溶解度曲线,设计由Na2Cr2O7溶液制备K2Cr2O7固体的实验方案(实验中须选用的试剂:硫酸溶液、NaOH溶液、KCl固体、蒸馏水)____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关碱金属元素的叙述正确的是( )
A. 碱金属单质均为银白色,密度均小于水
B. 碱金属单质从Li到Cs,熔点依次升高
C. 氢氧化铯碱性强于氢氧化钠
D. 碱金属元素形成的阳离子,从Li+到Cs+氧化性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子得到一个电子后3p轨道全充满;D最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,有F+和F2+两种离子。回答下列问题:
(1)元素电负性:D____E (填>、<或=);
(2)B、C单质熔点B_____C(填>、<或=);
(3)AE4中A原子杂化轨道方式为:________杂化;其固态晶体类型为_____________;
(4)氢化物的沸点:B比D高的原因______________;
(5)F的核外电子排布式为____________________________;向F的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出深蓝色晶体,该晶体的化学式为_______,其中关于该晶体下列说法中正确的是_____________________。
A.加入乙醇的目的是降低溶剂的极性,促使晶体析出
B.F与NH3之间的化学键为离子键
C.该配合物晶体中,N是配位原子,NH3为三角锥型
D.配离子内N原子排列成为平面正方形,则其中F离子是sp3杂化
E.向该晶体的水溶液中加入浓BaCl2溶液有白色沉淀生成
(6)元素X的某价态阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元为立方体,结构如图所示。该晶体中每个Xn-被________个等距离的C+离子包围。已知该晶体的密度为ρg.cm-3,阿伏加德罗常数为NA,CnX的摩尔质量为M g/mol,C+和Xn-间的最短距离是_____________nm。(列出计算式即可)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)、按要求填空:
①、第三周期中有两个成单电子的元素符号是__________。
②、四核10电子的粒子的电子式(写一种)__________。
③、第四周期中,3d轨道半充满的元素符号是__________。
(2)、写出符合下列条件的元素原子的电子排布式:
①、自然界中含量居第二的金属元素__________。
②、第四周期0族元素__________。
③、能形成自然界中最硬的单质的元素__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的量浓度关系中,不正确的是:
A. 等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B. 浓度相同的下列溶液: ①(NH4) 2 Fe(SO4)2 ②(NH4) 2 CO3 ③(NH4) 2SO4 ,NH4+浓度由大到小的顺序是:①>③>②
C. 浓度均为0.1 mol·L-1CH3COONa、NaHCO3、![]() -ONa溶液中:若c(OH-)分别为c1、c2、c3,则c3>c2>c1
-ONa溶液中:若c(OH-)分别为c1、c2、c3,则c3>c2>c1
D. NaHCO3溶液中:c(Na+)=c(H2CO3)+c(HCO3-)+2c(CO32-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com