
【题目】如下图所示,一密闭容器被无摩擦、可滑动的两隔板a、b分成甲、乙两室;标准状况下,在乙室中充入0.6mol HCl,甲室中充入NH3、H2的混合气体,静止时活塞位置如下图。已知甲、乙两室中气体的质量之差为10.9g。下列说法正确的是

A.甲室的质量为32.8g或11g
B.甲室气体的体积为22.4L
C.甲室中NH3和H2的物质的量之比为2:3
D.抽开隔板a,已知NH3+HCl=NH4Cl(固体),隔板b最终停在3处
【答案】B
【解析】
A. 在乙室中HCl气体的物质的质量是0.6mol×36.5g/mol=21.9g,因为单位体积的NH3或H2的质量都比HCl小,所以混合气体的质量也比HCl少。则混合气体的质量是21.9g-10.9g=11.0g,故A错误;
B. 在同温同压下,气体的体积比等于它们的物质的量的比,n(混合):n(HCl)=5:3;由于n(HCl)=0.6mol,则n(混合):0.6=5:3;n(混合)=1mol,标准状况下,体积为22.4L,故B正确;
C. 假设混合气体NH3、H2的物质的量分别是x、y。则x+y=1,17x+2y=11。解得x=0.6mol;y=0.4mol。所以在甲室中NH3、H2的物质的量之比n(NH3):n(H2)=0.6:0.4=3:2,故C错误;
D. 将隔板a去掉,发生下列反应:HCl(g)+NH3(g)=NH4Cl(s),由于n(HCl)= n(NH3)=0.6mol,当HCl与NH3充分反应后,容器中的HCl和NH3恰好反应得到NH4Cl固体,最后只剩余0.4mol的氢气。由于在同温同压下,气体的体积比等于它们的物质的量的比,所以0.6mol的气体具有3个体积,则0.4mol的气体占据2个体积。因此充分反应后,活塞b将位于刻度“2”处,故D错误;
正确答案是B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】磺酰氯(SO2Cl2)在医药、染料行业有重要用途,也可用于制备表面活性剂。沸点为69.2℃,遇水水解,剧烈反应生成两种强酸。学习小组在实验室用SO2和Cl2在活性炭作用下,制备SO2Cl2并测定产品纯度,设计如图实验如图1(夹持装置略去)。请回答下列问题:
Ⅰ.SO2的制备
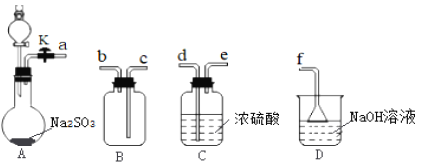
(1)欲收集一瓶干燥的SO2,装置中气流方向合理的连接顺序为____(填小写字母)。
(2)A装置分液漏斗中装的是70%的硫酸溶液,A中反应的化学方程式为____。
Ⅱ.SO2Cl2的制备和纯度的测定
将上述收集到的SO2充入注射器h中,用图2装置制备SO2Cl2。

(3)仪器e的名称为____,b中试剂的名称为____。
(4)f的作用是____。
(5)取反应后的产品4.0g,配成200mL溶液;取出20.00mL,用0.5000mol ·L-1NaOH溶液滴定;达到滴定终点时消耗标准液的体积为20.00mL(杂质不参加反应)。
①产品加水配成溶液时发生的反应为____。
②SO2Cl2的质量分数为____。(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海带中提取碘的工业生产过程如下:

下列说法不正确的是 ( )
A.试剂X可以为NaOH溶液,其作用是使浸泡液中的可溶性有机物形成沉淀
B.氧化剂可以用H2O2或适量的Cl2
C.干海带浸泡液中的碘离子可用淀粉溶液检验
D.氧化后的滤液在实验室也可采用四氯化碳萃取、分液、蒸馏的方法得到粗碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中溶质的物质的量浓度为1 mol/L的是
A.将40g NaOH溶解于1L水中配成的溶液
B.将80gSO3溶于水配成1L溶液(已知,SO3+H2O=H2SO4)
C.将0.5mol/L的NaNO3溶液100mL加热蒸发掉50g水后的溶液
D.含K+为2mol的K2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、D、E、W是中学常见的四种元素,原子序数依次增大,A的原子最外层电子数是次外层的2倍,D的氧化物属于两性氧化物,D、E位于同周期,A、D、E的原子最外层电子数之和为14,W是人体必需的微量元素,缺W会导致贫血症状。
(1)写出AE4的电子式:____________________。
(2)下列事实能用元素周期律解释的是(填字母序号)___________。
a.D的最高价氧化物对应水化物的碱性弱于Mg(OH)2
b.E的气态氢化物的稳定性小于HF
c.WE3的溶液可用于刻蚀铜制的印刷电路板
(3)NaCN是一种有剧毒的盐,用E的一种氧化物EO2可以除去水溶液中含有的该有毒物质,得到一种生活中常见的固体和两种无毒气体。写出该反应的离子方程式:_________________________________________。
(4)工业上用电解法制备D的单质,反应的化学方程式为_____________________。
(5)W的单质可用于处理酸性废水中的NO3-,使其转换为NH4+,同时生成有磁性的W的氧化物X,再进行后续处理。
①上述反应的离子方程式为___________________________________________。
②D的单质与X在高温下反应的化学方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. AlCl3溶液中加入过量氨水:Al3++4NH3·H2O===AlO![]() +2H2O+4NH
+2H2O+4NH![]()
B. 硫化钠的水解反应:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
C. 将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合HCO![]() +Ba2++OH-===BaCO3↓+H2O
+Ba2++OH-===BaCO3↓+H2O
D. 单质铜与稀硝酸反应:Cu+2H++2NO![]() ===Cu2++2NO↑+H2O
===Cu2++2NO↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列叙述错误的是
A.向0.1 mol·L-1的醋酸溶液中加水或通入HCl气体都能使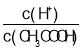 值增大
值增大
B.0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后溶液显酸性,则有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)
C.pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH<7
D.0.1 mol·L-1某一元酸HA溶液中![]() =1×10-8,则该溶液中由水电离出的c(H+)=1×10-11mol·L-1
=1×10-8,则该溶液中由水电离出的c(H+)=1×10-11mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对金属制品进行搞腐蚀处理,可延长其使用寿命。
(1)以下为铝村表面处理的一种方法:
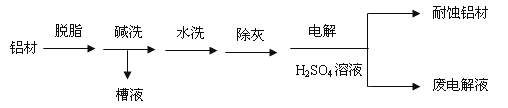
①碱洗的目的是除去铝村表面的自然氧化膜,碱洗衣时候常有气泡冒出,原因是:________(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的__________。
a.NH3b.CO2c.NaOH d.HNO3
②以铝村为阳极,在H2SO4溶液中电解,铝村表面形成氧化膜,阳极电极反应式为:_____。
取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是_________。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是 。
(3)利用下图装置,可以模拟铁的电化学防护。

若X为碳棒,为减缓铁的腐蚀,开关K应该置于 处。
若X为锌,开关K置于M处,该电化学防护法称为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超临界状态下的CO2流体溶解性与有机溶剂相似,可提取中药材的有效成分,工艺流程如下。

下列说法中错误的是( )
A.浸泡时加入乙醇有利于中草药有效成分的浸出
B.高温条件下更有利于超临界CO2流体萃取
C.升温、减压的目的是实现CO2与产品分离
D.超临界CO2流体萃取中药材具有无溶剂残留、绿色环保等优点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com