
【题目】常温下,下列叙述错误的是
A.向0.1 mol·L-1的醋酸溶液中加水或通入HCl气体都能使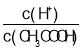 值增大
值增大
B.0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后溶液显酸性,则有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)
C.pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH<7
D.0.1 mol·L-1某一元酸HA溶液中![]() =1×10-8,则该溶液中由水电离出的c(H+)=1×10-11mol·L-1
=1×10-8,则该溶液中由水电离出的c(H+)=1×10-11mol·L-1
【答案】B
【解析】
A、向0.1 mol·L-1的醋酸溶液中加水则醋酸的电离平衡正向移动,氢离子的物质的量增加,醋酸的物质的量减少,溶液的体积是相同的,所以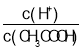 增大,通入HCl气体,氢离子浓度增大,平衡逆向移动,醋酸根离子的浓度减小,
增大,通入HCl气体,氢离子浓度增大,平衡逆向移动,醋酸根离子的浓度减小,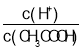 =Ka/c(CH3COO-),醋酸根离子浓度减小,电离常数不变,则比值增大,A正确;
=Ka/c(CH3COO-),醋酸根离子浓度减小,电离常数不变,则比值增大,A正确;
B、0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后得到等浓度的醋酸钠和醋酸的混合液,溶液显酸性,说明醋酸的电离程度大于醋酸根离子的水解程度,醋酸的电离是微弱的,所以醋酸的浓度大于氢离子浓度,则c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),B错误;
C、pH=4的醋酸中氢离子浓度与pH=10的氢氧化钠溶液中氢氧根离子的浓度相等,醋酸是弱酸,所以醋酸溶液的浓度大于氢氧化钠溶液的浓度,等体积混合,则醋酸过量,溶液的pH<7,C正确;
D、酸溶液中的氢氧根离子来自水的电离,Kw=1×10-14,所以![]() =1×10-8时,则c(OH-)=1×10-11mol/L,水电离产生的氢离子与氢氧根离子浓度相等,所以该溶液中由水电离出的c(H+)=1×10-11mol·L-1,D正确;
=1×10-8时,则c(OH-)=1×10-11mol/L,水电离产生的氢离子与氢氧根离子浓度相等,所以该溶液中由水电离出的c(H+)=1×10-11mol·L-1,D正确;
答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】碱式碳酸铜可用于有机催化剂、杀虫剂及饲料中铜的添加剂,还可用于烟火和颜料制造。CuSO4溶液与Na2CO3溶液反应能否得到碱式碳酸铜?某班同学进行相关探究。
(沉淀制备)取一定量胆矾(CuSO4·5H2O)溶于水,再滴几滴稀硫酸,充分搅拌后得到一定体积的CuSO4溶液。向其中加适量Na2CO3溶液,将所得蓝绿色悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤。
(1)用无水乙醇洗涤的目的是________。
(实验探究)同学们设计了如下装置,用制得的蓝绿色固体进行实验:
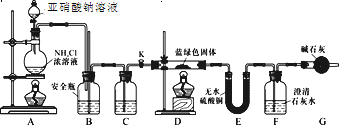
(2)D装置加热前,需要首先打开活塞K,用A装置制取适量N2,然后关闭K,点燃D处酒精灯。A中产生的N2将装置中的空气排除,避免干扰。C中盛装的试剂应是________。
(3)装置A中发生反应的离子方程式为________。
(4)若蓝绿色固体的组成为xCuCO3·yCu(OH)2,实验能观察到的现象是________。
(5)同学们查阅文献知:Ksp(CaCO3)=2.8×10-9,Ksp(BaCO3)=5.1×10-9,经讨论认为需要用Ba(OH)2代替Ca(OH)2来定量测定蓝绿色固体的化学式,其原因是________。
a.Ba(OH)2的碱性比Ca(OH)2强
b.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
c.相同条件下,CaCO3的溶解度明显大于BaCO3
d.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
(6)待D中反应完全后,打开活塞K,再次滴加NaNO2溶液产生N2,其目的是________。若定量分析所取蓝绿色固体质量为27.1 g,装置F中使用Ba(OH)2溶液,实验结束后,装置E的质量增加2.7 g,F中产生沉淀19.7 g。则该蓝绿色固体的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸牛奶中的乳酸可增进食欲、促进胃液分泌、增强肠胃的消化功能,对人体具有保健作用,乳酸分子的结构简式为![]() 。工业上可由乙烯来合成乳酸,方法如下:
。工业上可由乙烯来合成乳酸,方法如下:
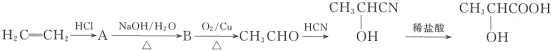
(1)乳酸所含的官能团的名称是______。
(2)写出下列物质转化的化学方程式:
①A→B______。
②![]() __________。
__________。
(3)A在一定条件下可发生消去反应,写出其发生消去反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,一密闭容器被无摩擦、可滑动的两隔板a、b分成甲、乙两室;标准状况下,在乙室中充入0.6mol HCl,甲室中充入NH3、H2的混合气体,静止时活塞位置如下图。已知甲、乙两室中气体的质量之差为10.9g。下列说法正确的是

A.甲室的质量为32.8g或11g
B.甲室气体的体积为22.4L
C.甲室中NH3和H2的物质的量之比为2:3
D.抽开隔板a,已知NH3+HCl=NH4Cl(固体),隔板b最终停在3处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.8g铁与100 mL稀硫酸恰好完全反应,反应前后溶液体积的变化忽略不计。求:
(1)产生的气体在标准状况下的体积。_______
(2)反应完全后,所得溶液中亚铁离子的物质的量浓度。_______
(3)反应前溶液中H+物质的量溶度。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中用二氧化锰和浓盐酸反应制取氯气的化学方程式为MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑,请回答下列问题:
MnCl2+2H2O+Cl2↑,请回答下列问题:
(1)上述反应中 ______ 元素的化合价降低,被 ______ (填“氧化”或“还原”)。
(2)若消耗0.1mol MnO2,则还原剂的物质的量是 ______ mol,反应过程中转移电子的物质的量为 ______ mol。
(3)上述反应中浓盐酸表现出的化学性质是 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平。E是具有果香气味的液体。A、B、C、D、E在一定条件下存在如下转化关系(部分反应条件、产物被省略)。
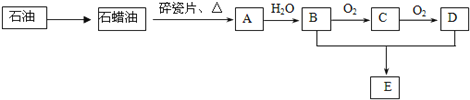
请回答下列问题:
(1)工业上,由石油获得石蜡油的方法是___________________。
(2)丁烷是由石蜡油获得A的过程中的中间产物之一,它的一种同分异构体中含有三个甲基(—CH3),则这种同分异构体的结构简式是:___________________;D物质中官能团的名称是_______________。
(3)A、B共0.1 mol,完全燃烧消耗O2的体积是_______(标准状况下)。
(4)反应B→C的化学方程式为______________________。
(5)反应B+D→E的化学方程式为______________________;该反应的速率比较缓慢,实验中为了提高该反应的速率,通常采取的措施有__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.4 mol·L-1NaOH溶液450 mL。
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是____________(填仪器名称)。

(2)下列操作中,容量瓶所不具备的功能有______________(填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E. 用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为 _________g,在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后没有干燥就开始移液,则所得溶液浓度 _____ 0.4 mol·L-1(填“大于”“等于”或“小于”,下同);若NaOH溶液在转移至容量瓶时未经冷却,则所得溶液浓度_____0.4mol·L-1;若定容时俯视刻度线,则所得溶液浓度_____0.4mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际计量大会第26 届会议新修订了阿伏加德罗常数(NA=6.02214076×1023 mol―1), 并将于2019 年 5月20 日正式生效。下列说法中正确的是
A. 在 1 mol![]() 中,含有的中子数为 6 NA
中,含有的中子数为 6 NA
B. 将7.1 g C12溶于水制成饱和氯水,转移的电子数为 0.1 NA
C. 标准状况下,11.2 L NO和11. 2 L O2混合后,气体的分子总数为 0.75 NA
D. 某温度下,1L pH= 3的醋酸溶液稀释到10L 时,溶液中 H+的数目大于0.01 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com