
【题目】实验室中用二氧化锰和浓盐酸反应制取氯气的化学方程式为MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑,请回答下列问题:
MnCl2+2H2O+Cl2↑,请回答下列问题:
(1)上述反应中 ______ 元素的化合价降低,被 ______ (填“氧化”或“还原”)。
(2)若消耗0.1mol MnO2,则还原剂的物质的量是 ______ mol,反应过程中转移电子的物质的量为 ______ mol。
(3)上述反应中浓盐酸表现出的化学性质是 ______ 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在25℃、101kPa时,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则2C(s)+2H2(g)+O2(g)= CH3COOH(l)的焓变为( )
A. -488.3kJ/molB. 488.3kJ/molC. 191kJ/molD. -191kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中溶质的物质的量浓度为1 mol/L的是
A.将40g NaOH溶解于1L水中配成的溶液
B.将80gSO3溶于水配成1L溶液(已知,SO3+H2O=H2SO4)
C.将0.5mol/L的NaNO3溶液100mL加热蒸发掉50g水后的溶液
D.含K+为2mol的K2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. AlCl3溶液中加入过量氨水:Al3++4NH3·H2O===AlO![]() +2H2O+4NH
+2H2O+4NH![]()
B. 硫化钠的水解反应:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
C. 将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合HCO![]() +Ba2++OH-===BaCO3↓+H2O
+Ba2++OH-===BaCO3↓+H2O
D. 单质铜与稀硝酸反应:Cu+2H++2NO![]() ===Cu2++2NO↑+H2O
===Cu2++2NO↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列叙述错误的是
A.向0.1 mol·L-1的醋酸溶液中加水或通入HCl气体都能使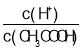 值增大
值增大
B.0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后溶液显酸性,则有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)
C.pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH<7
D.0.1 mol·L-1某一元酸HA溶液中![]() =1×10-8,则该溶液中由水电离出的c(H+)=1×10-11mol·L-1
=1×10-8,则该溶液中由水电离出的c(H+)=1×10-11mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.5 L某浓度的NaCl溶液中含有0.5 mol NaCl,下列对该溶液的说法中,不正确的是
A. 该溶液溶质的物质的量浓度为1 mol·L-1
B. 该溶液中含有58.5 g NaCl
C. 配制100 mL该溶液需用5.85 g NaCl
D. 量取100 mL该溶液倒入烧杯中,烧杯中的NaCl物质的量为0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对金属制品进行搞腐蚀处理,可延长其使用寿命。
(1)以下为铝村表面处理的一种方法:
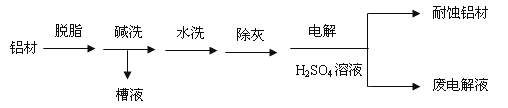
①碱洗的目的是除去铝村表面的自然氧化膜,碱洗衣时候常有气泡冒出,原因是:________(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的__________。
a.NH3b.CO2c.NaOH d.HNO3
②以铝村为阳极,在H2SO4溶液中电解,铝村表面形成氧化膜,阳极电极反应式为:_____。
取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是_________。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是 。
(3)利用下图装置,可以模拟铁的电化学防护。

若X为碳棒,为减缓铁的腐蚀,开关K应该置于 处。
若X为锌,开关K置于M处,该电化学防护法称为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,124 g P4中所含P—P键数目为4NA
B. 100 mL 1mol·L1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧光盘金属层中含有金属Ag(其它金属微量忽略不计),从光盘中提取金属 Ag 的工艺流程如下。请回答下列问题。

(1)“氧化”阶段需在 80 ℃ 条件下进行,使用的加热方式为______________________。
(2)NaClO溶液与Ag 反应的产物为AgCl、NaOH 和O2,该反应的化学方程式为____________。有人提出用HNO3代替 NaClO氧化Ag,从反应产物的角度分析,其缺点是______________。
(3)“过滤Ⅰ”中洗涤难溶物的实验操作为_____________________________________。
(4)常用10%的氨水溶解AgCl固体, AgCl与 NH3H2O按 1:2 反应可生成 Cl-和一种阳离子_____(填阳离子的化学式)的溶液。实际反应中,即使氨水过量,“废渣”中也含有少量AgCl固体,可能的原因是__________________________________________。
(5)理论上消耗 0.1 mol N2H4H2O可“还原”得到_____ g Ag的单质。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com