
【题目】在25℃、101kPa时,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则2C(s)+2H2(g)+O2(g)= CH3COOH(l)的焓变为( )
A. -488.3kJ/molB. 488.3kJ/molC. 191kJ/molD. -191kJ/mol
【答案】A
【解析】
25℃、101kPa下,C(s)、H2(g)和CH3COOH(l)的燃烧热分别是393.5kJ/mol、285.8kJmol-1和870.3kJmol-1,则①C(s)+O2(g)=CO2(g) △H=-393.5kJmol-1,②H2(g)+![]() O2(g)=H2O(l) △H=-285.8kJmol-1,③CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H=-870.3kJmol-1,由盖斯定律可知,②×2+①×2-③可得反应2C(s)+2H2(g)+O2(g)=CH3COOH(1) △H=2×(-393.5kJmol-1)+2×(-285.8kJmol-1)+870.3kJmol-1=-488.3kJmol-1,故选A。
O2(g)=H2O(l) △H=-285.8kJmol-1,③CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H=-870.3kJmol-1,由盖斯定律可知,②×2+①×2-③可得反应2C(s)+2H2(g)+O2(g)=CH3COOH(1) △H=2×(-393.5kJmol-1)+2×(-285.8kJmol-1)+870.3kJmol-1=-488.3kJmol-1,故选A。


科目:高中化学 来源: 题型:
【题目】二甲醚是一种清洁能源,用水煤气制取甲醚的原理如下:
I.![]()
II.![]()
(1)则![]() 的△H= ________(用△H1、△H2表示)
的△H= ________(用△H1、△H2表示)
(2)300℃和500℃时,反应I的平衡常数分别为K1、K2,且K1>K2,则其正反应为______反应(填”吸热”’或”放热”)。
(3)在恒容密闭容器中发生反应I:

①如图能正确反映体系中甲醇体积分数随温度变化情况的曲线是____(填“a”或“b”)。
②下列说法能表明反应已达平衡状态的是____(填标号)。
A.容器中气体的压强不再变化 B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化 D.v正(H2)=2v正(CH3OH)
(4)500K时,在2L密闭容器中充入4molCO和8molH2,4min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3),则:
① 0~4min,反应I的v(H2)=________,反应I的平衡常数K=________。
②反应II中CH3OH的转化率α=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将如图中的K闭合,下列判断正确的是( )

A.去掉盐桥,此装置也能正常工作
B.盐桥中的K+向盛有硫酸铜溶液的烧杯移动,高锰酸根离子向b移动
C.一段时间后,硫酸铜溶液浓度减小
D.C极上的电极反应式为Fe3++e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把6.5gZn放入足量的盐酸中,锌完全反应。计算:
(1)6.5gZn的物质的量?_________。
(2)参加反应的HCl的物质的量?_________。
(3)生成氢气的体积(标准状况)?__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜可用于有机催化剂、杀虫剂及饲料中铜的添加剂,还可用于烟火和颜料制造。CuSO4溶液与Na2CO3溶液反应能否得到碱式碳酸铜?某班同学进行相关探究。
(沉淀制备)取一定量胆矾(CuSO4·5H2O)溶于水,再滴几滴稀硫酸,充分搅拌后得到一定体积的CuSO4溶液。向其中加适量Na2CO3溶液,将所得蓝绿色悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤。
(1)用无水乙醇洗涤的目的是________。
(实验探究)同学们设计了如下装置,用制得的蓝绿色固体进行实验:
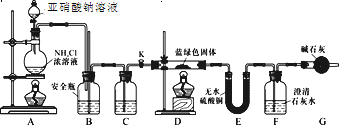
(2)D装置加热前,需要首先打开活塞K,用A装置制取适量N2,然后关闭K,点燃D处酒精灯。A中产生的N2将装置中的空气排除,避免干扰。C中盛装的试剂应是________。
(3)装置A中发生反应的离子方程式为________。
(4)若蓝绿色固体的组成为xCuCO3·yCu(OH)2,实验能观察到的现象是________。
(5)同学们查阅文献知:Ksp(CaCO3)=2.8×10-9,Ksp(BaCO3)=5.1×10-9,经讨论认为需要用Ba(OH)2代替Ca(OH)2来定量测定蓝绿色固体的化学式,其原因是________。
a.Ba(OH)2的碱性比Ca(OH)2强
b.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
c.相同条件下,CaCO3的溶解度明显大于BaCO3
d.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
(6)待D中反应完全后,打开活塞K,再次滴加NaNO2溶液产生N2,其目的是________。若定量分析所取蓝绿色固体质量为27.1 g,装置F中使用Ba(OH)2溶液,实验结束后,装置E的质量增加2.7 g,F中产生沉淀19.7 g。则该蓝绿色固体的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于指定粒子构成的几种描述中正确的是
A.![]() C与
C与![]() C是不同的核素,所以分别由这两种原子构成的石墨化学性质不同
C是不同的核素,所以分别由这两种原子构成的石墨化学性质不同
B.H2O和D2O是同分异构体
C.H3O+与-OH具有相同的电子数
D.37Cl与39K具有相同的中子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)分别取m g钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是____________________。
(2)分别取0.1 mol 钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是________________________。
(3)若都产生0.25 mol的氢气,所需钠、铁、铝的质量比是________________________。
(4)若产生相同体积(同温同压)的氢气,所需钠、铁、铝三种金属的物质的量之比是________________________。
(5)若产生相同质量的氢气,钠、铁、铝三种金属转移电子的物质的量之比是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 常温下a g某烷烃(CnH2n+2)中含有共用电子对数目为![]()
B. 标准状况下,11.2 L CH2Cl2中含有分子的数目为0.5NA
C. 56g聚乙烯中含有碳碳双键的数目为2NA
D. 常温下,0.2 mol/L的FeCl3溶液中含Cl-数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中用二氧化锰和浓盐酸反应制取氯气的化学方程式为MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑,请回答下列问题:
MnCl2+2H2O+Cl2↑,请回答下列问题:
(1)上述反应中 ______ 元素的化合价降低,被 ______ (填“氧化”或“还原”)。
(2)若消耗0.1mol MnO2,则还原剂的物质的量是 ______ mol,反应过程中转移电子的物质的量为 ______ mol。
(3)上述反应中浓盐酸表现出的化学性质是 ______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com