
����Ŀ��(1)�ֱ�ȡm g�ơ������������������ᷴӦ������ͬ�����²����������������____________________��
(2)�ֱ�ȡ0.1 mol �ơ������������������ᷴӦ������ͬ�����²����������������________________________��
(3)��������0.25 mol�������������ơ�����������������________________________��
(4)��������ͬ���(ͬ��ͬѹ)�������������ơ����������ֽ��������ʵ���֮����________________________��
(5)��������ͬ�������������ơ����������ֽ���ת�Ƶ��ӵ����ʵ���֮����________________________________��
���𰸡�![]() 1:2:3 23:28:9 6:3:2 1:1:1
1:2:3 23:28:9 6:3:2 1:1:1
��������
�����漰���Ļ�ѧ����ʽ�Т�2Na+2HCl=2NaCl+H2������Fe+2HCl=FeCl2+H2������2Al+6HCl=2AlCl3+3H2�������ݸ���Ӧ������ʵ�����ϻ�ѧ����ʽ���㡣
(1)�ơ��������ڷ�Ӧ�зֱ�ʧȥ1��2��3�����ӣ�mg�ơ������������ʵ����ֱ�Ϊ![]() mol��
mol��![]() mol��
mol��![]() mol���ɵ��ӵ�ʧת���غ�ɵã�2 mol������1 mol������1 mol������1 mol������2 mol������3 mol�������������������������Ϊ
mol���ɵ��ӵ�ʧת���غ�ɵã�2 mol������1 mol������1 mol������1 mol������2 mol������3 mol�������������������������Ϊ![]() mol:
mol:![]() mol:
mol:![]() mol��
mol��![]() ��
��
(2)�ֱ�ȡ0.1mol�ơ����������������ᷴӦ����2Na+2HCl=2NaCl+H2����Fe+HCl=FeCl2+H2����2Al+6HCl=AlCl3+3H2����������ͬ�����²��������������=0.05mol��0.1mol��0.15mol=1��2��3��
(3)��������0.25 mol����������2Na+2HCl=2NaCl+H2����Fe+HCl=FeCl2+H2����2Al+6HCl=AlCl3+3H2�����������ơ������������ʵ���֮��=0.25mol��2��0.25mol��0.25��![]() mol=6��3��2����������=6��23��3��56����2��27=23��28��9��
mol=6��3��2����������=6��23��3��56����2��27=23��28��9��
(4)��������ͬ�����ͬ��ͬѹ�£���H2���������֮������Ӧ�����ʵ���֮�ȣ����趼��1mol�����ݷ�Ӧ2Na+2HCl=2NaCl+H2����Fe+HCl=FeCl2+H2����2Al+6HCl=AlCl3+3H2������������ơ�þ�������ʵ�����Ϊ2��1��![]() =6��3��2��
=6��3��2��
(5)�ӵ�ʧ���ӵĽǶȿ��ǣ�2��H+�õ�������������1��H2��H+�õ��ĵ��ӣ��ɻ��ý����ṩ����������ͬ���������������ơ����������ֽ���ת�Ƶ��ӵ����ʵ�����ȣ����ơ����������ֽ���ת�Ƶ��ӵ����ʵ���֮����1:1:1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С��������CuO��NH3��Ӧ���о�NH3��ij�����ʲ��ⶨ����ɣ����������ʵ��װ��(�г�װ��δ����)����ʵ�顣��ش��������⣺
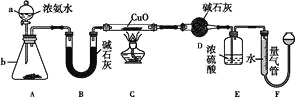
(1)����a������Ϊ____������b�п�ѡ����Լ�Ϊ____��
(2)ʵ������,����װ��A��������ȡ����ɫ������____(����ĸ)��
A��Cl2 | B��O2 | C��CO2 | D��NO2 |
(3)ʵ���й۲쵽װ��C�к�ɫCuO��ĩ��Ϊ��ɫ���壬����������ɫ��ζ�������������������֤��NH3����____��,д����Ӧ�Ļ�ѧ����ʽ:_______________________��
(4)Eװ����Ũ�����������_____________________________________��
(5)��ȡ�������ǰ��Ӧ��װ��F���еIJ�����____________________________��
(6)ʵ����ϣ�����ø����D����m g��װ��F�����������Ϊn L��������ɱ�״�����������е������ԭ�Ӹ�����Ϊ____���ú�m��n��ĸ�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(SO2Cl2)��ҽҩ��Ⱦ����ҵ����Ҫ��;��Ҳ�������Ʊ�������Լ����е�Ϊ69.2�棬��ˮˮ�⣬���ҷ�Ӧ��������ǿ�ᡣѧϰС����ʵ������SO2��Cl2�ڻ���̿�����£��Ʊ�SO2Cl2���ⶨ��Ʒ���ȣ������ͼʵ����ͼ1(�г�װ����ȥ)����ش��������⣺
��.SO2���Ʊ�
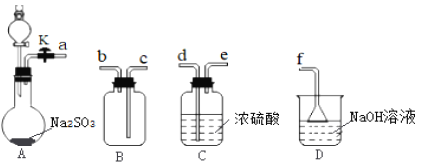
��1�����ռ�һƿ�����SO2��װ���������������������˳��Ϊ____(��Сд��ĸ)��
��2��Aװ�÷�Һ©����װ����70%��������Һ��A�з�Ӧ�Ļ�ѧ����ʽΪ____��
��.SO2Cl2���Ʊ��ʹ��ȵIJⶨ
�������ռ�����SO2����ע����h�У���ͼ2װ���Ʊ�SO2Cl2��

��3������e������Ϊ____��b���Լ�������Ϊ____��
��4��f��������____��
��5��ȡ��Ӧ��IJ�Ʒ4.0g�����200mL��Һ��ȡ��20.00mL����0.5000mol ��L-1NaOH��Һ�ζ����ﵽ�ζ��յ�ʱ���ı�Һ�����Ϊ20.00mL(���ʲ��μӷ�Ӧ)��
�ٲ�Ʒ��ˮ�����Һʱ�����ķ�ӦΪ____��
��SO2Cl2����������Ϊ____��(������λ��Ч����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25�桢101kPaʱ��C(s)��H2(g)��CH3COOH(l)��ȼ���ȷֱ�Ϊ393.5kJ/mol��285.8kJ/mol��870.3kJ/mol����2C(s)+2H2(g)+O2(g)= CH3COOH(l)���ʱ�Ϊ( )
A. -488.3kJ/molB. 488.3kJ/molC. 191kJ/molD. -191kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���㡢Ϻ������С�ӱ������������ס��ҡ�������(��ͼ)�������ų��ķ�Һ�ÿ������ֻ�� Na2CO3��CuCl2��Ca(OH)2��HCl �е�һ�֡�ij��ѧ����С��Ժ�ˮ���ʱ���֣��� �״���ˮ�����ҳ���ɫ���� �Ҵ���ˮ�����ɫ���DZ�dz��ɫ���ǣ��� ������ˮ�ɻ���壻�� �����������ݣ���ˮ���壬���ƶϣ�
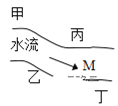
(1)���������ų��ķ�Һ�ﺬ�е���Ⱦ���_______����________����_______����________��
(2)��M��ȡ���ĺ�ˮ�У��϶����е�������____________________��
(3)д�����������ܷ��������ӷ���ʽ______________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��BHT��һ�ֳ��õ�ʳƷ�����������ɶԼ�����(![]() )�ϳ�BHT�ij��÷�����2��(��ͼ)������˵������ȷ���ǣ� ��
)�ϳ�BHT�ij��÷�����2��(��ͼ)������˵������ȷ���ǣ� ��

A. BHT��ʹ����KMnO4��Һ��ɫB. BHT��Լ����ӻ�Ϊͬϵ��
C. ����һ��ԭ�������ʸ��ڷ�����D. BHT�м���Ũ��ˮ����ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
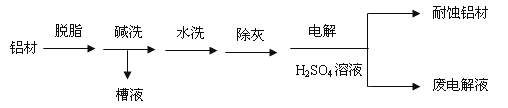
����Ŀ���Ӻ�������ȡ��Ĺ�ҵ�����������£�

����˵������ȷ���� �� ��
A.�Լ�X����ΪNaOH��Һ����������ʹ����Һ�еĿ������л����γɳ���
B.������������H2O2��������Cl2
C.�ɺ�������Һ�еĵ����ӿ��õ�����Һ����
D.���������Һ��ʵ����Ҳ�ɲ������Ȼ�̼��ȡ����Һ������ķ����õ��ֵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�����ʵ����ʵ���Ũ��Ϊ1 mol/L����
A.��40g NaOH�ܽ���1Lˮ����ɵ���Һ
B.��80gSO3����ˮ���1L��Һ����֪��SO3+H2O=H2SO4��
C.��0.5mol/L��NaNO3��Һ100mL����������50gˮ�����Һ
D.��K+Ϊ2mol��K2SO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Խ�����Ʒ���и㸯ʴ���������ӳ���ʹ��������
��1������Ϊ������洦����һ�ַ�����
����ϴ��Ŀ���dz�ȥ����������Ȼ����Ĥ����ϴ��ʱ��������ð����ԭ���ǣ�________�������ӷ���ʽ��ʾ����Ϊ����ϴ��Һ�е����Գ�����ʽ���գ�������Һ�м��������Լ��е�__________��
a.NH3b.CO2c.NaOH d.HNO3
��������Ϊ��������H2SO4��Һ�е�⣬��������γ�����Ĥ�������缫��ӦʽΪ��_____��
ȡ�����ϵ��Һ������NaHCO3��Һ��������ݺͰ�ɫ����������������ԭ����_________��
(2)��ͭ�ɷ�ֹ����Ʒ��ʴ�����ʱ��ͭ������ʯī��������ԭ���� ��
��3��������ͼװ�ã�����ģ�����ĵ绯ѧ������

��XΪ̼����Ϊ�������ĸ�ʴ������KӦ������ ����
��XΪп������K����M�����õ绯ѧ��������Ϊ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com