
【题目】煤燃烧后的主要产物是CO、CO2 . 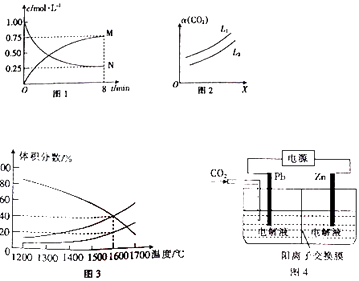
(1)已知:①C(s)+H2O(g)CO(g)+H2(g)△H1=+131.3KJ/mol
②C(s)+2H2O(g)CO2(g)+2H2(g)△H2=+90.0kJ/mol
③CO2(g)+H2(g)CO(g)+H2O(g)△H3
△H3=kJ/mol,在反应①的体系中加入催化剂,△H1(填“增大”“减小”或“不变”).
(2)以CO2为原料可制备甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol,向1L 的恒容密闭容器中充入1molCO2(g)和3mol H2(g),测得CO2(g)和CH3OH(g)浓度随时间的变化如图1 所示.
①图1中N表示的是(填化学式);0~8min内,以氢气表示的平均反应速率v(H2)=mol/(Lmin).
②在一定条件下,体系中CO2的平衡转化率(α)与L和X的关系如图2 所示,L和X分别表示温度或压强.X表示的物理量是(填“温度”或“压强”),L1 (填“>”或“<”) L2 .
(3)向一体积为20L的恒容密闭容器中通入1molCO2发生反应2CO2(g)═2CO(g)+O2(g),在不同温度下各物质的体积分数变化如图3所示.1600℃时反应达到平衡,则此时反应的平衡常数K= .
(4)草酸锌可应用于有机合成、电子工业等.工业上制取ZnC2O4的原理如图4所示(电解液不参加反应),Zn电极是(填“正”“负”“阴”或“阳”)极.已知在Pb电极区得到ZnC2O4 , 则Pb电极上的电极反应式为
【答案】
(1)+41.3;不变
(2)CO2;0.28;压强;<
(3)0.0125
(4)阳;2CO2+2e﹣=C2O42﹣
【解析】解:(1)已知:①C(s)+H2O(g)CO(g)+H2(g)△H1=+131.3KJ/mol
②C(s)+2H2O(g)CO2(g)+2H2(g)△H2=+90.0kJ/mol
③CO2(g)+H2(g)CO(g)+H2O(g)△H3
盖斯定律计算①﹣②得到CO2(g)+H2(g)CO(g)+H2O(g)△H3=+41.3kJ/mol,
在反应①的体系中加入催化剂,催化剂改变化学反应速率不改变化学平衡,反应的△H1不变,
所以答案是:+41.3;不变;(2)①结合化学平衡三行计算列式计算,向1L 的恒容密闭容器中充入1molCO2(g)和3mol H2(g),测得CO2(g)和CH3OH(g)浓度随时间的变化如图1 所示,N起始量为1.00mol/L为二氧化碳,平衡后二氧化碳的为0.25mol/L,物质的量为0.25mol,
CO2(g)+ | 3H2(g) | CH3OH(g)+ | H2O(g) | ||
起始量(mol) | 1 | 3 | 0 | 0 | |
变化量(mol) | 0.75 | 2.25 | 0.75 | 0.75 | |
平衡量(mol) | 0.25 | 0.75 | 0.75 | 0.75 |
反应速率v(H2)= ![]() =
= ![]() =0.28mol/(Lmin);
=0.28mol/(Lmin);
所以答案是:CO2;0.28;
②在一定条件下,体系中CO2的平衡转化率(α)与L和X的关系如图2 所示,L和X分别表示温度或压强,反应为气体体积减小的放热反应,利用平衡影响原理分析,升温平衡想吸热反应方向进行,增大压强平衡向气体体积减小的方向进行,图像可知X增大CO2的平衡转化率(α),说明平衡正向进行则X为增大压强,L为温度变化,温度升高平衡逆向进行,二氧化碳转化率越大,温度越低,则L1<L2 ,
所以答案是:压强;<;(3)向一体积为20L的恒容密闭容器中通入1molCO2发生反应2CO2(g)═2CO(g)+O2(g),在不同温度下各物质的体积分数变化如图3所示.图像中1600°C减少的为二氧化碳,平衡体积分数为40%,1600℃时反应达到平衡,
设二氧化碳消耗浓度为x,
2CO2(g) | ═ | 2CO(g)+ | O2(g) | |
起始量(mol/L) | 0.05 | 0 | 0 | |
变化量(mol/L) | x | x | 0.5 x | |
平衡量(mol/L) | 0.05﹣x | x | 0.5x |
![]() =40%
=40%
x=0.025mol/L
平衡常数K= ![]() =0.0125,
=0.0125,
所以答案是:0.0125;(4)利用电化学还原CO2制取ZnC2O4 , 则Zn失电子,所以Zn在阳极上失电子生成锌离子,即锌与正极相连为阳极;Pb电极上CO2得电子生成C2O42﹣ , 则其电极反应为:2CO2+2e﹣=C2O42﹣;
所以答案是:阳;2CO2+2e﹣=C2O42﹣ .
【考点精析】本题主要考查了反应热和焓变和化学平衡的计算的相关知识点,需要掌握在化学反应中放出或吸收的热量,通常叫反应热;反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】在工业上常用CO和H2合成甲醇,反应方程式为:CO(g)+2H2(g)CH3OH(g)△H=akJ/mol
已知:①CO(g)+ ![]() O2(g)═CO2(g)△H1=﹣283.0kJ/mol
O2(g)═CO2(g)△H1=﹣283.0kJ/mol
②H2(g)+ ![]() O2(g)═H2O(g)△H2=﹣241.8kJ/mol
O2(g)═H2O(g)△H2=﹣241.8kJ/mol
③CH3OH(g)+ ![]() O2(g)═CO2(g)+2H2O(g)△H3=﹣192.2kJ/mol
O2(g)═CO2(g)+2H2O(g)△H3=﹣192.2kJ/mol
答下列问题:
(1)a=
(2)能说明反应CO(g)+2H2(g)CH3OH(g)已达平衡状态的是(填字母).
A.单位时间内生成1mol CH3OH(g)的同时消耗了1mol CO(g)
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,气体的平均摩尔质量不再变化
(3)在T1℃时,体积为2L的恒容容器中充人物质的量之
和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与 ![]() 的关系如图1所示.
的关系如图1所示.
①当起始 ![]() =2,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)= . 若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将(选填“增大”、“减小”或“不变”);
=2,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)= . 若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将(选填“增大”、“减小”或“不变”);
②当 ![]() =3.5时,达到平衡状态后,CH3 OH的体积分数可能是图像中的点(选填“D”、“E”或“F”)
=3.5时,达到平衡状态后,CH3 OH的体积分数可能是图像中的点(选填“D”、“E”或“F”)
(4)CO和H2来自于天然气.已知CO2(g)+CH4 (g)2CO(g)+2H2 (g).在密闭容器中有浓度均为0.1molL﹣1的CH4与CO2 , 在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强p1p2(选填“大于”或“小于”);当压强为p2时,在y点:v(正)v(逆)(选填“大于”、“小于”或“等于”).若p2=3MPa,则T℃时该反应的平衡常数Kp=MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数). 
(5)含有甲醇的废水会造成环境污染,可通入ClO2气体将其氧化为CO2 . 写出相关反应的离子方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光纤通讯是光导纤维传送信号的一种通讯手段,合成光导纤维及氮化硅(一种无机涂层)的工艺流程如图: 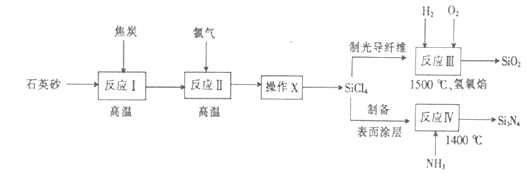
回答下列问题:
(1)反应I的化学方程式为 , 氧化剂为(填化学式).
(2)经反应II所得的四氯化硅粗品中所含的物质如表:
组分名称 | SiCl4 | SiHCl3 | SiH2Cl2 | HCl | BCl3 | PCl3 |
质量分数 | 0.545 | 0.405 | 0.0462 | 0.0003 | 0.00193 | 0.00157 |
沸点/℃ | 57.6 | 31.8 | 8.2 | ﹣85 | 12.5 | 75.5 |
图中“操作X”的名称为;PCl3的电子式为 .
(3)反应III和IV中尾气的用途为;反应IV的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
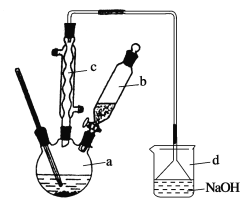
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了________气体。继续滴加至液溴滴完。装置d的作用是______________;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是____________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是________;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为________,要进一步提纯,下列操作中必须的是________(填入正确选项前的字母);
A.重结晶 B.过滤
C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是________(填入正确选项前的字母)。
A.25 mL B.50 mL
C.250 mL D.500 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得. 下列有关说法正确的是( ) 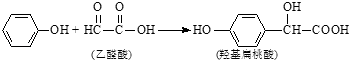
A.苯酚和羟基扁桃酸互为同系物
B.常温下,1mol羟基扁桃酸只能与1mol Br2反应
C.乙醛酸的核磁共振氢谱中只有1个吸收峰
D.羟基扁桃酸可以发生取代、氧化、加成等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
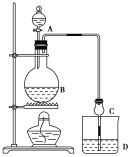
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)浓硫酸的作用是________;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:__________。
(2)球形干燥管C的作用是_______________。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)________________;反应结束后D中的现象是____________________。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性大小:羧酸>碳酸>酚,下列含溴化合物中的溴原子,在适当条件下都能被羟其(﹣OH)取代(均可称之为水解反应),所得产物能跟NaHCO3溶液反应的是( )
A.
B.
C.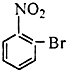
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究有机物一般经过以下几个基本步骤:分离、提纯→确定实验式→确定分子式→确定结构式.有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色粘稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
实 验 步 骤 | 解 释 或 实 验 结 论 |
(i)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空: |
(ii)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g. | (ii)A的分子式为 . ] |
(iii)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况). | (iii)用结构简式表示A中含有的官能团 . |
(iv)A的核磁共振氢谱如图: | (iv)A中含有种氢原子. |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子一定能大量共存的是
A. 在无色溶液中:NH4+、Fe2+、SO42-、CO32-
B. 在含大量Ba2+溶液中:NH4+、Na+、Cl-、CO32-
C. 在强碱溶液中:Na+、K+、Cl-、SO32-
D. 在酸性的溶液中:K+、Fe2+、Cl-、CH3COO-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com