
【题目】光纤通讯是光导纤维传送信号的一种通讯手段,合成光导纤维及氮化硅(一种无机涂层)的工艺流程如图: 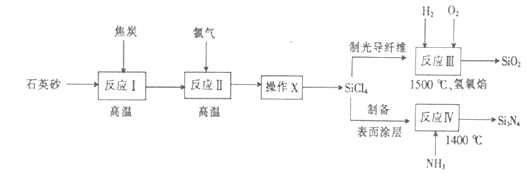
回答下列问题:
(1)反应I的化学方程式为 , 氧化剂为(填化学式).
(2)经反应II所得的四氯化硅粗品中所含的物质如表:
组分名称 | SiCl4 | SiHCl3 | SiH2Cl2 | HCl | BCl3 | PCl3 |
质量分数 | 0.545 | 0.405 | 0.0462 | 0.0003 | 0.00193 | 0.00157 |
沸点/℃ | 57.6 | 31.8 | 8.2 | ﹣85 | 12.5 | 75.5 |
图中“操作X”的名称为;PCl3的电子式为 .
(3)反应III和IV中尾气的用途为;反应IV的化学方程式为 .
【答案】
(1)SiO2+2C ![]() Si+2CO↑;SiO2
Si+2CO↑;SiO2
(2)精馏(或蒸馏);
(3)制取盐酸;3SiCl4+4NH3 ![]() Si3N4+12HCl
Si3N4+12HCl
【解析】解:(1)根据以上分析,反应I为焦炭和石英砂高温条件下发生反应生成Si和CO,方程式为:SiO2+2C ![]() Si+2CO↑,Si化合价降低,则氧化剂为SiO2 , 故答案为:SiO2+2C
Si+2CO↑,Si化合价降低,则氧化剂为SiO2 , 故答案为:SiO2+2C ![]() Si+2CO↑;SiO2;(2)根据所得的四氯化硅粗品中所含的物质的沸点不同,经过蒸馏得到纯SiCl4 , 所以“操作X”的名称为精馏(或蒸馏),PCl3为共价化合物,则电子式为
Si+2CO↑;SiO2;(2)根据所得的四氯化硅粗品中所含的物质的沸点不同,经过蒸馏得到纯SiCl4 , 所以“操作X”的名称为精馏(或蒸馏),PCl3为共价化合物,则电子式为 ![]() ,故答案为:精馏(或蒸馏);
,故答案为:精馏(或蒸馏); ![]() ;(3)反应Ⅲ为SiCl4与氢气、氧气在1500℃时反应生成SiO2和HCl,方程式为:SiCl4+O2+2H2
;(3)反应Ⅲ为SiCl4与氢气、氧气在1500℃时反应生成SiO2和HCl,方程式为:SiCl4+O2+2H2 ![]() SiO2+4HCl,反应IV为SiCl4与NH3在1400℃时反应生成Si3N4和HCl,方程式为:3SiCl4+4NH3
SiO2+4HCl,反应IV为SiCl4与NH3在1400℃时反应生成Si3N4和HCl,方程式为:3SiCl4+4NH3 ![]() Si3N4+12HCl,所以反应III和IV中尾气HCl的用途为制取盐酸,
Si3N4+12HCl,所以反应III和IV中尾气HCl的用途为制取盐酸,
故答案为:制取盐酸;3SiCl4+4NH3 ![]() Si3N4+12HCl.
Si3N4+12HCl.
根据流程反应I为焦炭和石英砂高温条件下发生反应生成Si和CO,反应Ⅱ主要为Si与氯气高温反应生成SiCl4 , 根据所得的四氯化硅粗品中所含的物质的沸点不同,经过精馏(或蒸馏)得到纯SiCl4 , 反应Ⅲ为SiCl4与氢气、氧气在1500℃时反应生成SiO2和HCl,反应IV为SiCl4与NH3在1400℃时反应生成Si3N4和HCl,据此分析解答.


科目:高中化学 来源: 题型:
【题目】抗生素药物“芬必得”的主要成分的结构简式如图所示: ![]()
下列关于“芬必得”的叙述中正确的是( )
A.该物质属于不饱和烃
B.该物质的分子式为C13H20O2
C.该物质属于羧酸类有机物
D.该物质属于芳香烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬烯是一种食用香精,其结构简式如图.有关柠檬烯的分析正确的是( ) 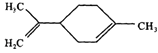
A.柠檬烯的分子式为C10H14
B.它的一氯代物有8种
C.它和丁基苯互为同分异构体
D.一定条件下,它分别可以发生加成、取代、氧化反应,但不能发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为____________。
(2)A与溴的四氯化碳溶液反应的化学方程式为____________,反应类型是____________。
(3)已知: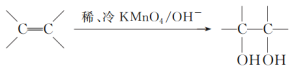 。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式___________。
。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式___________。
(4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式__________________。
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能在溶液中大量共存的一组离子是
A. Cu2+、SO42-、OH-、K+B. Na+、CO32-、H+、Cl-
C. H+、Cl-、NO3-、Ba2+D. Ba2+、H+、SO42-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧后的主要产物是CO、CO2 . 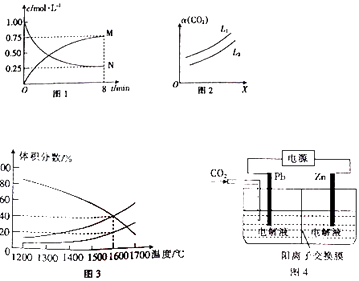
(1)已知:①C(s)+H2O(g)CO(g)+H2(g)△H1=+131.3KJ/mol
②C(s)+2H2O(g)CO2(g)+2H2(g)△H2=+90.0kJ/mol
③CO2(g)+H2(g)CO(g)+H2O(g)△H3
△H3=kJ/mol,在反应①的体系中加入催化剂,△H1(填“增大”“减小”或“不变”).
(2)以CO2为原料可制备甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol,向1L 的恒容密闭容器中充入1molCO2(g)和3mol H2(g),测得CO2(g)和CH3OH(g)浓度随时间的变化如图1 所示.
①图1中N表示的是(填化学式);0~8min内,以氢气表示的平均反应速率v(H2)=mol/(Lmin).
②在一定条件下,体系中CO2的平衡转化率(α)与L和X的关系如图2 所示,L和X分别表示温度或压强.X表示的物理量是(填“温度”或“压强”),L1 (填“>”或“<”) L2 .
(3)向一体积为20L的恒容密闭容器中通入1molCO2发生反应2CO2(g)═2CO(g)+O2(g),在不同温度下各物质的体积分数变化如图3所示.1600℃时反应达到平衡,则此时反应的平衡常数K= .
(4)草酸锌可应用于有机合成、电子工业等.工业上制取ZnC2O4的原理如图4所示(电解液不参加反应),Zn电极是(填“正”“负”“阴”或“阳”)极.已知在Pb电极区得到ZnC2O4 , 则Pb电极上的电极反应式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,则有关此电池推断正确的是( )
A.通入乙烷的电极为正极
B.参加反应的乙烷与氧气的物质的量之比为7∶2
C.放电一段时间后,KOH的物质的量浓度减少
D.负极反应式为C2H6+6H2O-14e-===2CO32-+18H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com