
����Ŀ���ڹ�ҵ�ϳ���CO��H2�ϳɼ״�����Ӧ����ʽΪ��CO��g��+2H2��g��CH3OH��g����H=akJ/mol
��֪����CO��g��+ ![]() O2��g���TCO2��g����H1=��283.0kJ/mol
O2��g���TCO2��g����H1=��283.0kJ/mol
��H2��g��+ ![]() O2��g���TH2O��g����H2=��241.8kJ/mol
O2��g���TH2O��g����H2=��241.8kJ/mol
��CH3OH��g��+ ![]() O2��g���TCO2��g��+2H2O��g����H3=��192.2kJ/mol
O2��g���TCO2��g��+2H2O��g����H3=��192.2kJ/mol
���������⣺
��1��a=
��2����˵����ӦCO��g��+2H2��g��CH3OH��g���Ѵ�ƽ��״̬����������ĸ����
A.��λʱ��������1mol CH3OH��g����ͬʱ������1mol CO��g��
B.�ں��º��ݵ������У����������ܶȱ��ֲ���
C.�ھ��Ⱥ��ݵ������У���Ӧ��ƽ�ⳣ�����ٱ仯
D.�ں��º�ѹ�������У������ƽ��Ħ���������ٱ仯
��3����T1��ʱ�����Ϊ2L�ĺ��������г������ʵ���֮
��Ϊ3mol��H2��CO����Ӧ�ﵽƽ��ʱCH3OH�����������V%���� ![]() �Ĺ�ϵ��ͼ1��ʾ��
�Ĺ�ϵ��ͼ1��ʾ��
�ٵ���ʼ ![]() =2������5min�ﵽƽ�⣬CO��ת����Ϊ0.6����0��5min��ƽ����Ӧ����v��H2��= �� ����ʱ���������м���CO��g����CH3OH��g����0.4mol������ƽ��ʱH2��ת���ʽ���ѡ���������С�����䡱����
=2������5min�ﵽƽ�⣬CO��ת����Ϊ0.6����0��5min��ƽ����Ӧ����v��H2��= �� ����ʱ���������м���CO��g����CH3OH��g����0.4mol������ƽ��ʱH2��ת���ʽ���ѡ���������С�����䡱����
�ڵ� ![]() =3.5ʱ���ﵽƽ��״̬��CH3 OH���������������ͼ���е��㣨ѡ�D������E����F����
=3.5ʱ���ﵽƽ��״̬��CH3 OH���������������ͼ���е��㣨ѡ�D������E����F����
��4��CO��H2��������Ȼ������֪CO2��g��+CH4 ��g��2CO��g��+2H2 ��g�������ܱ���������Ũ�Ⱦ�Ϊ0.1molL��1��CH4��CO2 �� ��һ�������·�Ӧ�����CH4��ƽ��ת�������¶ȼ�ѹǿ�Ĺ�ϵ��ͼ2����ѹǿp1p2��ѡ����ڡ���С�ڡ�������ѹǿΪp2ʱ����y�㣺v������v���棩��ѡ����ڡ�����С�ڡ����ڡ�������p2=3MPa����T��ʱ�÷�Ӧ��ƽ�ⳣ��Kp=MPa2����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ����������� 
��5�����м״��ķ�ˮ����ɻ�����Ⱦ����ͨ��ClO2���彫������ΪCO2 �� д����ط�Ӧ�����ӷ���ʽ
���𰸡�
��1����574.4
��2��CD
��3��0.12mol/��L��min��������F
��4��С�ڣ����ڣ�4
��5��6ClO2+5CH3OH=5CO2+6Cl��+7H2O+6H+
���������⣺��1����֪����CO��g��+ ![]() O2��g���TCO2��g����H1=��283.0kJ/mol��H2��g��+
O2��g���TCO2��g����H1=��283.0kJ/mol��H2��g��+ ![]() O2��g���TH2O��g����H2=��241.8kJ/mol
O2��g���TH2O��g����H2=��241.8kJ/mol
��CH3OH��g��+ ![]() O2��g���TCO2��g��+2H2O��g����H3=��192.2kJ/mol
O2��g���TCO2��g��+2H2O��g����H3=��192.2kJ/mol
���ݸ�˹���ɣ���+2���ک��ۿɵã�CO��g��+2H2��g��CH3OH��g�������H=��H1+2��H2����H3=����283.0kJ/mol��+2������241.8kJ/mol��������192.2kJ/mol��=��574.4kJ/mol��
���Դ��ǣ���574.4����2��A����λʱ��������1mol CH3OH��g����ͬʱ������1mol CO��g��������ʾ����Ӧ���ʣ���Ӧʼ�հ��ñ�����ϵ���У���λʱ��������1mol CH3OH��g����ͬʱ������1mol CO��g������˵������ƽ�⣬��A����
B������������������䣬�����ݻ��㶨�������ڻ��������ܶ�ʼ�ձ��ֲ��䣬��B����
C���ھ��Ⱥ��ݵ������У��淴Ӧ�����¶ȷ����仯��ƽ�ⳣ��Ҳ��֮�����仯������Ӧ��ƽ�ⳣ�����ٱ仯ʱ˵����Ӧ����ƽ�⣬��C��ȷ��
D������������������䣬�淴Ӧ���л�����������ʵ��������������ƽ��Ħ���������У��������ƽ��Ħ���������ٱ仯ʱ��˵����Ӧ����ƽ�⣬��D��ȷ��
��ѡ��CD����3����H2��CO�ܹ�Ϊ3mol������ʼ ![]() =2����֪H2Ϊ2mol��COΪ1mol��5min�ﵽƽ��ʱCO��ת����Ϊ0.6����
=2����֪H2Ϊ2mol��COΪ1mol��5min�ﵽƽ��ʱCO��ת����Ϊ0.6����
CO��g��+ | 2H2��g�� | CH3OH��g�� | ||
��ʼ��mol���� | 1 | 2 | 0 | |
�仯��mol���� | 0.6 | 1.2 | 0.6 | |
ƽ�⣨mol���� | 0.4 | 0.8 | 0.6 |
�������ݻ�Ϊ2L����v��H2��= ![]() =0.12mol/��L��min����
=0.12mol/��L��min����
���¶���ƽ�ⳣ��K= 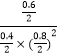 ����ʱ���������м���CO��g����CH3OH��g����0.4mol����ʱŨ����Qc=
����ʱ���������м���CO��g����CH3OH��g����0.4mol����ʱŨ����Qc= 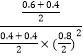 ��K=
��K= 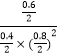 ����Ӧ������Ӧ���У�����ƽ��ʱH2��ת���ʽ�����
����Ӧ������Ӧ���У�����ƽ��ʱH2��ת���ʽ�����
���Դ��ǣ�0.12mol/��L��min��������
�ڻ�ϱ������ڻ�ѧ������֮��ʱ��ƽ��ʱ������ĺ�����ʵ� ![]() =3.5ʱ���ﵽƽ��״̬��CH3 OH���������С��C�㣬��ѡF��
=3.5ʱ���ﵽƽ��״̬��CH3 OH���������С��C�㣬��ѡF��
���Դ��ǣ�F����4������ӦΪ�������ʵ�������ķ�Ӧ���ϵ�ѹǿ�����ڷ�Ӧ������У�ѹǿԽ��ƽ��ʱ�����ת����Խ����ѹǿp1 ��p2��
��ѹǿΪp2ʱ����y�����ת����С��ƽ��ʱ��x�㣩��ת���ʣ���Ӧδ����ƽ�⣬Ӧ������е���ƽ�⣬����y�㣺v��������v���棩
��p2=3MPa��x����ת����Ϊ50%����
CO2��g��+ | CH4 ��g�� | 2CO��g��+ | 2H2 ��g�� | ||
��ʼŨ�ȣ�mol/L���� | 0.1 | 0.1 | 0 | 0 | |
�仯Ũ�ȣ�mol/L���� | 0.05 | 0.05 | 0.1 | 0.1 | |
ƽ��Ũ�ȣ�mol/L���� | 0.05 | 0.05 | 0.1 | 0.1 |
ƽ�ⳣ��Kp= ![]() =
= 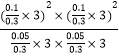 ��MPa��2=4��MPa��2 ��
��MPa��2=4��MPa��2 ��
���Դ��ǣ�С�ڣ����ڣ�4����5��ClO2���彫�״�����ΪCO2 �� ��������ԭΪCl�� �� ��ϵ���ת���غ㡢����غ���ԭ���غ���ƽ���ӷ���ʽΪ��6ClO2+5CH3OH=5CO2+6Cl��+7H2O+6H+ ��
���Դ��ǣ�6ClO2+5CH3OH=5CO2+6Cl��+7H2O+6H+ ��
�����㾫�������ڱ��⿼��Ļ�ѧƽ��״̬���ʼ������ͻ�ѧƽ��״̬���жϣ���Ҫ�˽⻯ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����״̬�жϣ���v(B��)=v(B��)��v(C��):v(D��)=x : y��c(C)��C%��n(C)%�Ȳ������A��B��C��DΪ���壬��m+n��x+y��ѹǿ�㶨����ϵ��ɫ�����λʱ����ij�����ڻ�ѧ���Ķ����������γ�������ϵƽ��ʽ���㶨��m+n �� x+y���Ȳ��ܵó���ȷ�𰸣�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ñ��͵��Ȼ�����Һ��ȡ�����������壬��ȷ�IJ�����
A. ��FeCl3��Һ��������ˮ�м���
B. ��FeCl3��Һ������ˮ�У��õ��ػ�ɫҺ�弴��
C. ��FeCl3��Һ�����ˮ�У���������У��õ����ɫҺ�弴��
D. ��FeCl3��Һ�����ˮ�У�������������������ɺ��ɫ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������漰��ѧ��Ӧ����
A.ͨ����ɨ����������������ԭ������д������B.14C���Ŷϴ�
C.ú���ͷ���õ�������ͬϵ��D.��ʳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п��һ��Ӧ�ù㷺�Ľ�����Ŀǰ��ҵ����Ҫ���á�ʪ��������ұ��п��ij��п�����Ҫ�ɷ�ΪZnS����������FeS�������ɷ֣�������Ϊԭ��ұ��п�Ĺ���������ͼ��ʾ�� 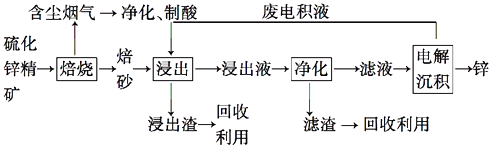
�ش��������⣺
��1����п����ı������������յķ���¯�н��У���������ɰ����Ҫ�ɷֵĻ�ѧʽΪ ��
��2�����չ����в����ĺ��������ɾ������ᣬ��������ں�����������
��3������Һ�������������м������Ҫ����Ϊ �� �������� ��
��4�������������е������������壬��������Pb��Ag�Ͻ���Ե缫�������ݳ������� ��
��5���Ľ���пұ�����գ������ˡ���ѹ�������ȫʪ�����̣���ʡ�������¿�����Ⱦ�ı��չ��̣��ֿɻ��һ���й�ҵ��ֵ�ķǽ������ʣ�����ѹ������з�����Ҫ��Ӧ�����ӷ���ʽΪ ��
��6���ҹ��Ŵ������á�������ұ��п��������Ӧ�����ġ��칤������й��ڡ�������Ǧ���ļ��أ���¯��ʯʮ�װ����һ����ڣ�����Ȼ�������ú̿����ʢ�������н�������Ѻ죬����������ٹ�ȡ������������ǦҲ��������п���չ�����Ҫ��Ӧ�Ļ�ѧ����ʽΪ �� ��ע��¯��ʯ����Ҫ�ɷ�Ϊ̼��п����Ǧ��ָ����п��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2016��8��10�ա�����ȡ����ijƣ����������塱CO��NO��H2S����Ϊ����ҩ�↑����DZ�ڰе㣬���Կ�����������ҩ�����������ƶ������༲���������й������������˵����ȷ���ǣ� �� 
A.���ǵ����
B.��������ˮ
C.���������Һ��Ӧ
D.�����ڹ��ۻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л������м��ܷ�����ȥ��Ӧ�����ܷ���ˮ�ⷴӦ���ǣ� ��
A.�Ҵ�
B.�ȼ���
C.������
D.��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ҩ��ұصá�����Ҫ�ɷֵĽṹ��ʽ��ͼ��ʾ�� ![]()
���й��ڡ��ұصá�����������ȷ���ǣ� ��
A.���������ڲ�������
B.�����ʵķ���ʽΪC13H20O2
C.�������������������
D.���������ڷ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��úȼ�պ����Ҫ������CO��CO2 �� 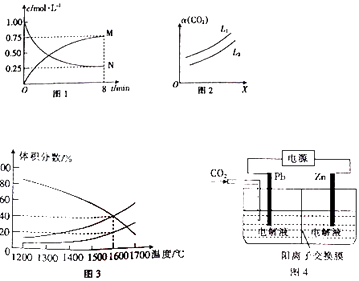
��1����֪����C��s��+H2O��g��CO��g��+H2��g����H1=+131.3KJ/mol
��C��s��+2H2O��g��CO2��g��+2H2��g����H2=+90.0kJ/mol
��CO2��g��+H2��g��CO��g��+H2O��g����H3
��H3=kJ/mol���ڷ�Ӧ�ٵ���ϵ�м����������H1���������С�����䡱����
��2����CO2Ϊԭ�Ͽ��Ʊ��״���CO2��g��+3H2��g��CH3OH��g��+H2O��g����H=��49.0kJ/mol����1L �ĺ����ܱ������г���1molCO2��g����3mol H2��g�������CO2��g����CH3OH��g��Ũ����ʱ��ı仯��ͼ1 ��ʾ��
��ͼ1��N��ʾ�������ѧʽ����0��8min�ڣ���������ʾ��ƽ����Ӧ����v��H2��=mol/��Lmin����
����һ�������£���ϵ��CO2��ƽ��ת���ʣ�������L��X�Ĺ�ϵ��ͼ2 ��ʾ��L��X�ֱ��ʾ�¶Ȼ�ѹǿ��X��ʾ��������������¶ȡ���ѹǿ������L1 ������������� L2 ��
��3����һ���Ϊ20L�ĺ����ܱ�������ͨ��1molCO2������Ӧ2CO2��g���T2CO��g��+O2��g�����ڲ�ͬ�¶��¸����ʵ���������仯��ͼ3��ʾ��1600��ʱ��Ӧ�ﵽƽ�⣬���ʱ��Ӧ��ƽ�ⳣ��K= ��
��4������п��Ӧ�����л��ϳɡ����ӹ�ҵ�ȣ���ҵ����ȡZnC2O4��ԭ����ͼ4��ʾ�����Һ���μӷ�Ӧ����Zn�缫�����������������������������������֪��Pb�缫���õ�ZnC2O4 �� ��Pb�缫�ϵĵ缫��ӦʽΪ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com