
����Ŀ��п��һ��Ӧ�ù㷺�Ľ�����Ŀǰ��ҵ����Ҫ���á�ʪ��������ұ��п��ij��п�����Ҫ�ɷ�ΪZnS����������FeS�������ɷ֣�������Ϊԭ��ұ��п�Ĺ���������ͼ��ʾ�� 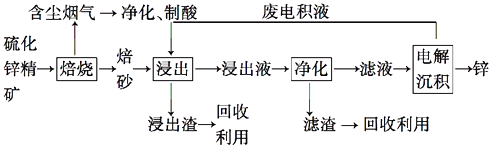
�ش��������⣺
��1����п����ı������������յķ���¯�н��У���������ɰ����Ҫ�ɷֵĻ�ѧʽΪ ��
��2�����չ����в����ĺ��������ɾ������ᣬ��������ں�����������
��3������Һ�������������м������Ҫ����Ϊ �� �������� ��
��4�������������е������������壬��������Pb��Ag�Ͻ���Ե缫�������ݳ������� ��
��5���Ľ���пұ�����գ������ˡ���ѹ�������ȫʪ�����̣���ʡ�������¿�����Ⱦ�ı��չ��̣��ֿɻ��һ���й�ҵ��ֵ�ķǽ������ʣ�����ѹ������з�����Ҫ��Ӧ�����ӷ���ʽΪ ��
��6���ҹ��Ŵ������á�������ұ��п��������Ӧ�����ġ��칤������й��ڡ�������Ǧ���ļ��أ���¯��ʯʮ�װ����һ����ڣ�����Ȼ�������ú̿����ʢ�������н�������Ѻ죬����������ٹ�ȡ������������ǦҲ��������п���չ�����Ҫ��Ӧ�Ļ�ѧ����ʽΪ �� ��ע��¯��ʯ����Ҫ�ɷ�Ϊ̼��п����Ǧ��ָ����п��
���𰸡�
��1��ZnO
��2������
��3��Zn�ۣ��û���Fe��
��4��O2
��5��2ZnS+4H++O2=2Zn2++2S��+2H2O
��6��ZnCO3+2C ![]() Zn+3CO��
Zn+3CO��
���������⣺��1����п�����Ҫ�ɷ���ZnS�����������������������ԭ��Ӧ����ɰ����Ҫ�ɷ�ΪZnO�����Դ��ǣ�ZnO����2���������ɵĺ����������ת��Ϊ���ᣬ���ں����Ľ������������Դ��ǣ���������3���ú�п���л�����FeS�����ʣ�����������ת��Ϊ�������ӣ��ɼ���п�۳�ȥ�������ӣ��Ӷ���ȥFe�����Դ��ǣ�Zn�ۣ��û���Fe�ȣ���4�������������У��ǵ��ZnSO4 �� ��������������Ӧ������ΪO2 �� ���Դ��ǣ�O2����5������ѹ�����������˼�壬��֪��Ӧ���к���H+��O2 �� ���Ի�÷ǽ�������S����ѧ����ʽΪ2ZnS+4H++O2=2Zn2++2S��+2H2O�����Դ��ǣ�2ZnS+4H++O2=2Zn2++2S��+2H2O����6��̼��п��̼�ڸ����·�Ӧ����п��һ����̼����ѧ����ʽΪ��ZnCO3+2C ![]() Zn+3CO�������Դ��ǣ�ZnCO3+2C
Zn+3CO�������Դ��ǣ�ZnCO3+2C ![]() Zn+3CO����
Zn+3CO����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ԭ�ӵ�����Ϊag��12Cԭ�ӵ�����Ϊbg����NA��ʾ�����ӵ�����������˵������ȷ���ǣ� ��
A.����ԭ�ӵ�Ħ������Ϊ ![]() g/mol
g/mol
B.1 mol ����ԭ������Ϊ��a NAg
C.xg ����ԭ�������ĵ�����Ϊ ![]()
D.yg ����ԭ�ӵ�������һ��Ϊ ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������Ҫ��Fe2O3��FeO������ΪAl2O3��SiO2�ȣ����������������ƣ�FeOOH�� ���Ʊ�������ͼ�� 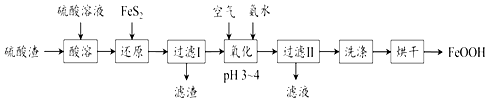
��֪��FeS2������ˮ������H2SO4��Ӧ���ڡ���ԭ�������У�Fe3+ͨ����Ӧ��FeS2��ԭ�����з�Ӧ��ΪFeS2+14Fe3++8H2O�T15Fe2++2SO42��+16H+����Ӧ������������Ϊ������
��1�������ܡ�������Ҫ�ʵ�������Ŀ���ǣ���������Ľ����ʣ��� ��
��2��д������ʱ����������Ҫ�ɷַ�����Ӧ��һ����ѧ����ʽ�� ��
��3������FeS2����ԭ��ʱ��Ӧ������ӷ���ʽΪ �� ��������Ҫ�ɷ���FeS2��S�����ѧʽ��
��4����������ʱ������FeOOH�����ӷ���ʽΪ �� ����ʱ���¶Ȳ��˹��ߣ�����ᵼ�²�Ʒ��ɫƫ�죬���ܺ��е����������ѧʽ����
��5����Һ��������Al2��SO4��3�����ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ͭ��Ũ��������ڼ��������·������·�Ӧ����Ӧ����ʽ����ƽ����
![]() ��ͨ����������������������⣺
��ͨ����������������������⣺
��1��A���ʿ��Ե���������γɡ�AӦ������________������ĸ������д����
a. �� b. �� c. �� d. ���������� e. ����������
��2��A���ʿ���ʹ����![]() ��Һ��ɫ���˷�Ӧ�У���д��ѧʽ����ͬ��_______ʧȥ���ӣ���������________��
��Һ��ɫ���˷�Ӧ�У���д��ѧʽ����ͬ��_______ʧȥ���ӣ���������________��
��3��������ͭƬ��10mL 18mol/L��Ũ![]() ��ַ�Ӧ������÷�Ӧ������ת����0.1mol���ӣ����ɵ�
��ַ�Ӧ������÷�Ӧ������ת����0.1mol���ӣ����ɵ�![]() �����ʵ���Ϊ_______mol�����ɵ�A�����ڱ�״�������Ϊ________L����������ȫ���ݳ�����
�����ʵ���Ϊ_______mol�����ɵ�A�����ڱ�״�������Ϊ________L����������ȫ���ݳ�����
��4�����㣺����Ӧ��õ�����Һ������![]() ��Һ��ϣ���ַ�Ӧ����Ӧ�����ó���������Ϊ______g��
��Һ��ϣ���ַ�Ӧ����Ӧ�����ó���������Ϊ______g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����ϵͳ�У���20.00mL 0.01000molL��1�Ĵ�����Һ����μ���0.01000mol��L��1��NaOH��Һ����û����Һ���¶ȱ仯��ͼ���������˵����ȷ���ǣ� �� 
A.��a����Һ�����ԣ���a���У�c��CH3COO������c��Na+����c��CH3COOH��
B.��b��c�� ![]() ������
������
C.ˮ�ĵ���̶ȣ�b�㣼c��
D.b����0.01000mol?L��1+c��H+��=c��Na��+��c��CH3COOH��+c��OH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڹ�ҵ�ϳ���CO��H2�ϳɼ״�����Ӧ����ʽΪ��CO��g��+2H2��g��CH3OH��g����H=akJ/mol
��֪����CO��g��+ ![]() O2��g���TCO2��g����H1=��283.0kJ/mol
O2��g���TCO2��g����H1=��283.0kJ/mol
��H2��g��+ ![]() O2��g���TH2O��g����H2=��241.8kJ/mol
O2��g���TH2O��g����H2=��241.8kJ/mol
��CH3OH��g��+ ![]() O2��g���TCO2��g��+2H2O��g����H3=��192.2kJ/mol
O2��g���TCO2��g��+2H2O��g����H3=��192.2kJ/mol
���������⣺
��1��a=
��2����˵����ӦCO��g��+2H2��g��CH3OH��g���Ѵ�ƽ��״̬����������ĸ����
A.��λʱ��������1mol CH3OH��g����ͬʱ������1mol CO��g��
B.�ں��º��ݵ������У����������ܶȱ��ֲ���
C.�ھ��Ⱥ��ݵ������У���Ӧ��ƽ�ⳣ�����ٱ仯
D.�ں��º�ѹ�������У������ƽ��Ħ���������ٱ仯
��3����T1��ʱ�����Ϊ2L�ĺ��������г������ʵ���֮
��Ϊ3mol��H2��CO����Ӧ�ﵽƽ��ʱCH3OH�����������V%���� ![]() �Ĺ�ϵ��ͼ1��ʾ��
�Ĺ�ϵ��ͼ1��ʾ��
�ٵ���ʼ ![]() =2������5min�ﵽƽ�⣬CO��ת����Ϊ0.6����0��5min��ƽ����Ӧ����v��H2��= �� ����ʱ���������м���CO��g����CH3OH��g����0.4mol������ƽ��ʱH2��ת���ʽ���ѡ���������С�����䡱����
=2������5min�ﵽƽ�⣬CO��ת����Ϊ0.6����0��5min��ƽ����Ӧ����v��H2��= �� ����ʱ���������м���CO��g����CH3OH��g����0.4mol������ƽ��ʱH2��ת���ʽ���ѡ���������С�����䡱����
�ڵ� ![]() =3.5ʱ���ﵽƽ��״̬��CH3 OH���������������ͼ���е��㣨ѡ�D������E����F����
=3.5ʱ���ﵽƽ��״̬��CH3 OH���������������ͼ���е��㣨ѡ�D������E����F����
��4��CO��H2��������Ȼ������֪CO2��g��+CH4 ��g��2CO��g��+2H2 ��g�������ܱ���������Ũ�Ⱦ�Ϊ0.1molL��1��CH4��CO2 �� ��һ�������·�Ӧ�����CH4��ƽ��ת�������¶ȼ�ѹǿ�Ĺ�ϵ��ͼ2����ѹǿp1p2��ѡ����ڡ���С�ڡ�������ѹǿΪp2ʱ����y�㣺v������v���棩��ѡ����ڡ�����С�ڡ����ڡ�������p2=3MPa����T��ʱ�÷�Ӧ��ƽ�ⳣ��Kp=MPa2����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ����������� 
��5�����м״��ķ�ˮ����ɻ�����Ⱦ����ͨ��ClO2���彫������ΪCO2 �� д����ط�Ӧ�����ӷ���ʽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���У�����
�ٽ���м����ϡHNO3�У�֤��Fe��H2����
��FeCl3��ʴCu ��ӡˢ��·������������ͭ�Ľ�����ǿ
�ۼ�����Һ���Ƿ���Fe2+��ȡ������������Һ�������м�������������ˮ���ٵμ�KSCN ��Һ���۲�ʵ������
�ܴ�������������ϡ��������ӷ���ʽΪ��3Fe2++4H++NO3-==3Fe3++NO��+3H2O
�ݽ�NaOHŨ��Һ�μӵ����͵�FeCl3��Һ�У��Ʊ�Fe(OH)3����
������������HI��Һ��Ӧ�����ӷ���ʽΪ: Fe(OH)3+3H+==Fe3++3H2O
������ˮ�����ڸ����µķ�Ӧ����ΪFe2O3 ��H2
��1mol FeI2������������Ӧʱת�Ƶĵ�����Ϊ3NA
�����Fe (NO3)2�����Ƿ��������ʵķ����ǽ�Fe (NO3) 2��Ʒ����ϡH2SO4�μ�KSCN ��Һ���۲���Һ�Ƿ���
��ͼʾװ���ܽϳ�ʱ��۲쵽Fe (OH) 2��ɫ����
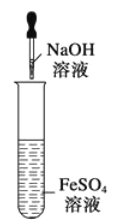
A. 1 B. 2 C. 3 D. 4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ֳ��á�����λ��NOx����������⻯�����ĵ������������Ƿ�ﵽ�ŷű����乤��ԭ����ͼ��ʾ������˵������ȷ���ǣ� �� 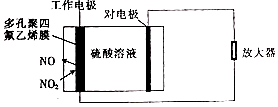
A.���Ե缫���Ǹ���
B.�������缫���Ϸ����ĵ缫��ӦΪNO2+2e��+2H+�TNO+H2O
C.����������ʱH+�ɹ����缫����Ե缫
D.�Ե缫�IJ��Ͽ���Ϊ���ý���п
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ǻ���������ҩ��ϳɵ���Ҫ�м��壬�����ɱ��Ӻ���ȩ�ᷴӦ�Ƶã� �����й�˵����ȷ���ǣ� �� 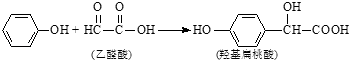
A.���Ӻ��ǻ������ụΪͬϵ��
B.�����£�1mol�ǻ�������ֻ����1mol Br2��Ӧ
C.��ȩ��ĺ˴Ź���������ֻ��1�����շ�
D.�ǻ���������Է���ȡ�����������ӳɵȷ�Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com