
【题目】利用硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)生产铁基颜料铁黄(FeOOH) 的制备流程如图: 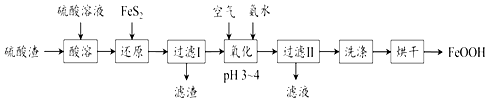
已知:FeS2难溶于水,不与H2SO4反应,在“还原”步骤中,Fe3+通过反应Ⅰ、Ⅱ被FeS2还原,其中反应Ⅰ为FeS2+14Fe3++8H2O═15Fe2++2SO42﹣+16H+;反应Ⅱ中氧化产物为单质硫.
(1)“酸溶”中硫酸要适当过量,目的是:①提高铁的浸出率;② .
(2)写出酸溶时硫酸渣中主要成分发生反应的一个化学方程式: .
(3)加入FeS2“还原”时反应Ⅱ的离子方程式为 . 滤渣的主要成分是FeS2、S和(填化学式)
(4)“氧化”时,生成FeOOH的离子方程式为 . 氧化时,温度不宜过高,否则会导致产品颜色偏红,可能含有的杂质是(填化学式).
(5)滤液中溶质是Al2(SO4)3和(填化学式).
【答案】
(1)抑制Fe3+水解
(2)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
(3)2Fe3++FeS2=3Fe2++2S;SiO2
(4)4Fe2++8NH3?H2O+O2=4FeOOH↓+8NH4++2H2O;Fe2O3
(5)(NH4)2SO4
【解析】解:(1)“酸溶”中硫酸要适当过量,目的是:①提高铁的浸出率;②抑制Fe3+水解;所以答案是:抑制Fe3+水解;(2)氧化铁是碱性氧化物,可以和硫酸反应生成硫酸铁和水,即Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,所以答案是:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;(3)由流程分析可知滤渣Ⅰ的主要成分是FeS2、S和SiO2;﹣2价的硫离子具有还原性,FeS2可以将溶液中的Fe3+还原为Fe2+ , 而本身被氧化为S沉淀,有关的离子方程式为2Fe3++FeS2=3Fe2++2S,
所以答案是:2Fe3++FeS2=3Fe2++2S;SiO2;(4)在碱性环境下,亚铁离子可以被氧气氧化为生成FeOOH,则“氧化”中,亚铁离子、氧气及氨水反应生成FeOOH、铵根离子和水,其离子方程式为4Fe2++8NH3H2O+O2=4FeOOH↓+8NH4++2H2O,温度过高,FeOOH分解生成Fe2O3而会导致产品颜色偏红;
所以答案是:4Fe2++8NH3H2O+O2=4FeOOH↓+8NH4++2H2O;Fe2O3;(5)滤液I中加氨水调节pH,会生成硫酸铵,所以滤液Ⅱ中溶质是Al2(SO4)3和 (NH4)2SO4;
所以答案是:(NH4)2SO4 .


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】铅蓄电池的总反应式为:PbO2+Pb+2H2SO4 ![]() 2PbSO4+2H2O据此判断下列叙述正确的是( )
2PbSO4+2H2O据此判断下列叙述正确的是( )
A.放电时,H2SO4浓度增加
B.放电时,负极的电极反应式为:Pb+SO42﹣﹣2e﹣═PbSO4
C.在充电时,电池中每转移1 mol电子,理论上生成2 mol硫酸
D.在充电时,阴极发生的反应是PbSO4﹣2e﹣+2H2O═PbO2+SO42﹣+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的Cu分别被足量的浓硝酸和稀硝酸氧化成硝酸铜,硝酸还原产物分别为NO2和NO两种气体,若不考虑其他反应,则在同温同压下NO2和NO的体积比为()
A. 3:1 B. 1:3 C. 1:1 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌,某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示: 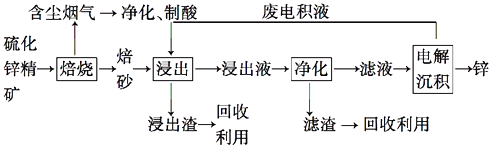
回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为 .
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的操作.
(3)浸出液“净化”过程中加入的主要物质为 , 其作用是 .
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb﹣Ag合金惰性电极,阳极逸出的气是 .
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质.“氧压酸浸”中发生主要反应的离子方程式为 .
(6)我国古代曾采用“火法”工艺冶炼锌,明代宋应星著的《天工开物》中有关于“升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,…,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…,冷淀,毁罐取出,…,即倭铅也.”该炼锌工艺过程主要反应的化学方程式为 . (注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬烯是一种食用香精,其结构简式如图.有关柠檬烯的分析正确的是( ) 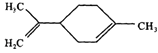
A.柠檬烯的分子式为C10H14
B.它的一氯代物有8种
C.它和丁基苯互为同分异构体
D.一定条件下,它分别可以发生加成、取代、氧化反应,但不能发生还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com