
【题目】下列变化需要加入还原剂才能实现的是()
A. CO32-→CO2 B. Cl-→Cl2 C. Cr2O72-→Cr3+ D. NH3→NO
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图所示,一密闭容器被无摩擦、可滑动的两隔板a、b分成甲、乙两室;标准状况下,在乙室中充入NH30.4mol,甲室中充入HCl、N2的混合气体,静止时隔板位置如图所示。已知甲、乙两室中气体的质量之差为17.3g。
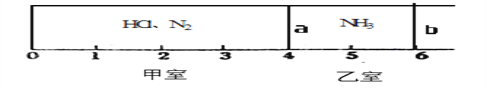
(1)甲室中HCl、N2的质量之比为__________________。
(2)将隔板a去掉,一段时间后,隔板b将稳定位于刻度“________”处(填数字,不考虑固体物质产生的压强),此时体系的平均相对分子质量为________。
Ⅱ.已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
溶质的物质的量浓度/molL-1 | 溶液的密度/gcm-3 | |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为________(不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1molL-1的硫酸与水等体积混合(混合后溶液的体积变化忽略不计),所得溶液的物质的量浓度为________molL-1。
(3)将物质的量浓度分别为c2molL-1和0.2c2molL-1的氨水等质量混合,所得溶液的物质的量浓度__________0.6c2molL-1(填“大于”、“小于”或“等于”)(设混合后溶液的体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】榄香烯是一种新型的抗癌药,它的结构简式如图,有关说法正确的是( ) 
A.榄香烯的分子式为C15H20
B.榄香烯属于芳香烃
C.1 mol 榄香烯最多能和3 mol H2反应
D.榄香烯不能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)生产铁基颜料铁黄(FeOOH) 的制备流程如图: 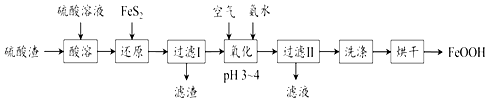
已知:FeS2难溶于水,不与H2SO4反应,在“还原”步骤中,Fe3+通过反应Ⅰ、Ⅱ被FeS2还原,其中反应Ⅰ为FeS2+14Fe3++8H2O═15Fe2++2SO42﹣+16H+;反应Ⅱ中氧化产物为单质硫.
(1)“酸溶”中硫酸要适当过量,目的是:①提高铁的浸出率;② .
(2)写出酸溶时硫酸渣中主要成分发生反应的一个化学方程式: .
(3)加入FeS2“还原”时反应Ⅱ的离子方程式为 . 滤渣的主要成分是FeS2、S和(填化学式)
(4)“氧化”时,生成FeOOH的离子方程式为 . 氧化时,温度不宜过高,否则会导致产品颜色偏红,可能含有的杂质是(填化学式).
(5)滤液中溶质是Al2(SO4)3和(填化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图1装置进行实验,试回答下列问题. 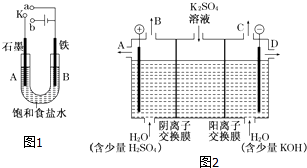
(1)若开始时开关K与a连接,则B极的电极反应式为 .
(2)若开始时开关K与b连接,则B极的电极反应式为 , 有关上述实验,下列说法正确的是(填序号) . ①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后通入适量HCl可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24L气体,则溶液中转移0.1mol电子
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图2装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾. ①该电解槽的阳极反应式为 . 此时通过阴离子交换膜的离子数(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数.
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”或“D”)导出.
③若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一隔热系统中,向20.00mL 0.01000molL﹣1的醋酸溶液中逐滴加入0.01000mol.L﹣1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( ) 
A.若a点溶液呈酸性,则a点有:c(CH3COO﹣)>c(Na+)>c(CH3COOH)
B.从b到c: ![]() 逐渐增大
逐渐增大
C.水的电离程度:b点<c点
D.b点有0.01000mol?L﹣1+c(H+)=c(Na)+﹣c(CH3COOH)+c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:AgCl、AgBr及AgI的Ksp依次为1.6×10﹣10、4.8×10﹣13和1.6×10﹣16 , 现将物质的量均为1.5×10﹣2mol的NaI,NaBr、NaCl和4.0×10﹣2mo1AgNO3混合配成1.0L水溶液,达到平衡时,下列说法正确的是( )
A.只生成AgBr及AgI两种沉淀
B.溶液中c(I﹣)≈1.0×10﹣9mol/L
C.溶液中c(Br﹣)≈3.0×10﹣5mol/L
D.溶液中c(Ag+)≈3.2×10﹣8mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com