
【题目】钠着火时,采用哪种灭火方式最好
A. 水B. 煤油C. 泡沫灭火器D. 砂子
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某同学想通过利用如图所示装置(夹持装置略去)实验,探究SO2与Na2O2反应的产物 
请分析:
(1)Ⅰ.装置B的作用装置D的作用
Ⅱ.对C中固体产物提出如下假设:假设1:只有Na2SO3 假设2:只有Na2SO4 假设3:
(2)若按假设2进行,反应方程式为
(3)若Na2O2反应完全,为确定C中固体产物的成分,甲同学设计如下实验:得出结论:假设2成立
C中的固体配成溶液 ![]() 白色沉淀
白色沉淀 ![]() 沉淀不溶解
沉淀不溶解
该方案是否合理(填“是”或“否”),理由是
(4)若假设2成立,反应前后C管增加6.4g,请计算10g含有杂质的Na2O2固体中,Na2O2的质量分数为(所含的杂质不与SO2发生反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)生产铁基颜料铁黄(FeOOH) 的制备流程如图: 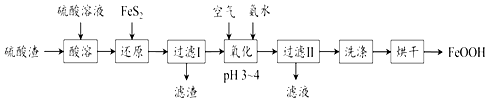
已知:FeS2难溶于水,不与H2SO4反应,在“还原”步骤中,Fe3+通过反应Ⅰ、Ⅱ被FeS2还原,其中反应Ⅰ为FeS2+14Fe3++8H2O═15Fe2++2SO42﹣+16H+;反应Ⅱ中氧化产物为单质硫.
(1)“酸溶”中硫酸要适当过量,目的是:①提高铁的浸出率;② .
(2)写出酸溶时硫酸渣中主要成分发生反应的一个化学方程式: .
(3)加入FeS2“还原”时反应Ⅱ的离子方程式为 . 滤渣的主要成分是FeS2、S和(填化学式)
(4)“氧化”时,生成FeOOH的离子方程式为 . 氧化时,温度不宜过高,否则会导致产品颜色偏红,可能含有的杂质是(填化学式).
(5)滤液中溶质是Al2(SO4)3和(填化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图1装置进行实验,试回答下列问题. 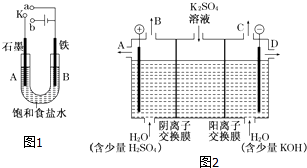
(1)若开始时开关K与a连接,则B极的电极反应式为 .
(2)若开始时开关K与b连接,则B极的电极反应式为 , 有关上述实验,下列说法正确的是(填序号) . ①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后通入适量HCl可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24L气体,则溶液中转移0.1mol电子
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图2装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾. ①该电解槽的阳极反应式为 . 此时通过阴离子交换膜的离子数(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数.
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”或“D”)导出.
③若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):
![]() 试通过计算和推理完成下面的问题:
试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。A应该属于________(用字母代号填写)。
a. 酸 b. 碱 c. 盐 d. 酸性氧化物 e. 碱性氧化物
(2)A物质可以使酸性![]() 溶液褪色,此反应中(填写化学式,下同)_______失去电子,氧化剂是________。
溶液褪色,此反应中(填写化学式,下同)_______失去电子,氧化剂是________。
(3)足量的铜片与10mL 18mol/L的浓![]() 充分反应,如果该反应过程中转移了0.1mol电子,生成的
充分反应,如果该反应过程中转移了0.1mol电子,生成的![]() 的物质的量为_______mol,生成的A气体在标准状况下体积为________L(假设气体全部逸出)。
的物质的量为_______mol,生成的A气体在标准状况下体积为________L(假设气体全部逸出)。
(4)计算:将反应后得到的溶液与足量![]() 溶液混合,充分反应。反应后所得沉淀的质量为______g。
溶液混合,充分反应。反应后所得沉淀的质量为______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一隔热系统中,向20.00mL 0.01000molL﹣1的醋酸溶液中逐滴加入0.01000mol.L﹣1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( ) 
A.若a点溶液呈酸性,则a点有:c(CH3COO﹣)>c(Na+)>c(CH3COOH)
B.从b到c: ![]() 逐渐增大
逐渐增大
C.水的电离程度:b点<c点
D.b点有0.01000mol?L﹣1+c(H+)=c(Na)+﹣c(CH3COOH)+c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的有()个
①将铁屑放入稀HNO3中,证明Fe比H2活泼
②FeCl3腐蚀Cu 制印刷电路板是由于铁比铜的金属性强
③检验溶液中是否含有Fe2+,取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN 溶液,观察实验现象
④磁性氧化铁溶于稀硝酸的离子方程式为:3Fe2++4H++NO3-==3Fe3++NO↑+3H2O
⑤将NaOH浓溶液滴加到饱和的FeCl3溶液中,制备Fe(OH)3胶体
⑥氢氧化铁与HI溶液反应的离子方程式为: Fe(OH)3+3H+==Fe3++3H2O
⑦铁与水蒸气在高温下的反应产物为Fe2O3 和H2
⑧1mol FeI2与足量氯气反应时转移的电子数为3NA
⑨检验Fe (NO3)2晶体是否氧化变质的方法是将Fe (NO3) 2样品溶于稀H2SO4后,滴加KSCN 溶液,观察溶液是否变红
⑩图示装置能较长时间观察到Fe (OH) 2白色沉淀
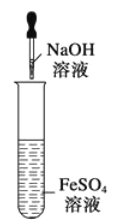
A. 1 B. 2 C. 3 D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完全沉淀等物质的量浓度的NaCl、MgCl2、AlCl3溶液中的Cl-,消耗等物质的量浓
度的AgNO3溶液的体积比为1:1:1,则上述溶液的体积比为 ( )
A. 6:3:2 B. 3:2:1 C. 1:1:1 D. 9:3:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com