
【题目】用饱和的氯化铁溶液制取氢氧化铁胶体,正确的操作是
A. 将FeCl3溶液滴入蒸馏水中即可
B. 将FeCl3溶液滴入热水中,得到棕黄色液体即可
C. 将FeCl3溶液滴入沸水中,并继续煮沸,得到红褐色液体即可
D. 将FeCl3溶液滴入沸水中,并继续加热煮沸至生成红褐色沉淀即可
科目:高中化学 来源: 题型:
【题目】图是一种天然药物桥环分子合成的部分路线图(反应条件已经略去):
已知:
①LiBH4可将醛、酮、酯类还原成醇,但不能还原羧酸、羧酸盐、碳碳双键;LiBH4遇酸易分解.
②RCH2COOR′ ![]() RCH(CH3)COOR′
RCH(CH3)COOR′
RCOR′ ![]() RCH(OH)R′R﹣COOR
RCH(OH)R′R﹣COOR ![]() RCH2OH+R′OH
RCH2OH+R′OH
请回答下列问题:
(1)有机物B中含氧官能团的名称 .
(2)反应A→B中需要加入试剂X,其分子式为C4H8O2 , X的结构简式为 .
(3)C用LiBH4还原得到D.C→D不直接用H2(镍作催化剂)还原的原因是 .
(4)写出一种满足下列条件的A的同分异构体的结构简式为 . ①属于芳香族化合物;②能使FeCl3溶液显色;③分子中有4种不同化学环境的氢.
(5)写出E和银氨溶液反应的化学方程式 .
(6)根据已有知识并结合相关信息,设计B→C的合成路线图(CH3I和无机试剂任选).合成路线流程图例如下:H2C=CH2 ![]() CH3CH2Br
CH3CH2Br ![]() CH3CH2OH.
CH3CH2OH.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( ) 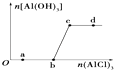
A.a点对应的溶液中:Na+、Fe3+、SO42﹣、HCO3﹣
B.b点对应的溶液中:Na+、S2﹣、SO42﹣、Cl﹣
C.c点对应的溶液中:K+、Ag+、Ca2+、NO3﹣
D.d点对应的溶液中:K+、NH4+、CO32﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图在盛有溴水的三支试管中分别加入汽油、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是( ) 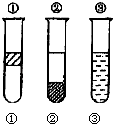
A.①加入的是CCl4 , ②加汽油,③加酒精
B.①加入的是酒精,②加CCl4 , ③加汽油
C.①加入的是汽油,②加酒精,③加CCl4
D.①加入的是汽油,②加CCl4 , ③加酒精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氧原子的质最为ag,12C原子的质量为bg,且NA表示阿伏加德罗常数,下列说法中正确的是( )
A.该氧原子的摩尔质量为 ![]() g/mol
g/mol
B.1 mol 该氧原子质量为幽a NAg
C.xg 该氧原子所含的电子数为 ![]()
D.yg 该氧原子的中子数一定为 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下V L的HCl气体溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρ g/mL,质量分数为ω,物质的量浓度为c mol/L,则下列关系中不正确的是( )
A.c= ![]()
B.ω= ![]()
C.ω= ![]()
D.ρ= ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“探险队员”﹣盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或者是水溶液),盐酸必须避开它们,否则就无法通过. 
(1)在能“吃掉”盐酸的化学反应中,属于酸碱中和反应的有个,属于氧化还原反应的有个,其中能“吃掉”盐酸的盐是(填化学式),写出该反应的离子方程式 .
(2)在不能与盐酸反应的物质中,属于电解质的是(填写物质序号,下同),属于非电解质的是
(3)请你帮助它走出迷宫(用图中物质前的序号连接起来表示所走的路线)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是以高铁酸盐(K2FeO4)和锌为电极材料,具有能量密度大、体积小、重量轻、寿命长、无污染等优点,除比亚迪外目前还没有其他厂家宣称其产品可以大规模实用化.电池的总反应为:3Zn+2K2FeO4+8H2O ![]() 3Zn(OH)2+2Fe(OH)3+4KOH.下列说法正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH.下列说法正确的是( )
A.充电时阳极反应式为:Zn﹣2e﹣+2OH﹣=Zn(OH)2
B.0.1molK2FeO4发生反应,转移电子数约为1.806×1024
C.充电时K2FeO4发生氧化反应
D.放电时正极反应为:2FeO42﹣+6e﹣+8H2O=2Fe(OH)3+10OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在工业上常用CO和H2合成甲醇,反应方程式为:CO(g)+2H2(g)CH3OH(g)△H=akJ/mol
已知:①CO(g)+ ![]() O2(g)═CO2(g)△H1=﹣283.0kJ/mol
O2(g)═CO2(g)△H1=﹣283.0kJ/mol
②H2(g)+ ![]() O2(g)═H2O(g)△H2=﹣241.8kJ/mol
O2(g)═H2O(g)△H2=﹣241.8kJ/mol
③CH3OH(g)+ ![]() O2(g)═CO2(g)+2H2O(g)△H3=﹣192.2kJ/mol
O2(g)═CO2(g)+2H2O(g)△H3=﹣192.2kJ/mol
答下列问题:
(1)a=
(2)能说明反应CO(g)+2H2(g)CH3OH(g)已达平衡状态的是(填字母).
A.单位时间内生成1mol CH3OH(g)的同时消耗了1mol CO(g)
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,气体的平均摩尔质量不再变化
(3)在T1℃时,体积为2L的恒容容器中充人物质的量之
和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与 ![]() 的关系如图1所示.
的关系如图1所示.
①当起始 ![]() =2,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)= . 若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将(选填“增大”、“减小”或“不变”);
=2,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)= . 若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将(选填“增大”、“减小”或“不变”);
②当 ![]() =3.5时,达到平衡状态后,CH3 OH的体积分数可能是图像中的点(选填“D”、“E”或“F”)
=3.5时,达到平衡状态后,CH3 OH的体积分数可能是图像中的点(选填“D”、“E”或“F”)
(4)CO和H2来自于天然气.已知CO2(g)+CH4 (g)2CO(g)+2H2 (g).在密闭容器中有浓度均为0.1molL﹣1的CH4与CO2 , 在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强p1p2(选填“大于”或“小于”);当压强为p2时,在y点:v(正)v(逆)(选填“大于”、“小于”或“等于”).若p2=3MPa,则T℃时该反应的平衡常数Kp=MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数). 
(5)含有甲醇的废水会造成环境污染,可通入ClO2气体将其氧化为CO2 . 写出相关反应的离子方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com