
 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
| A、属于氧化物 | B、属于硫酸盐 |
| C、属于钾盐 | D、属于电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
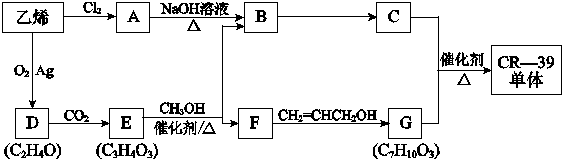
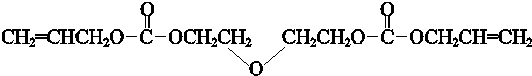
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 常温下状态 | 溶解性 | 稳定性 |
| 白色固体 | 易溶于水和乙醇,难溶于CCl4 | 在干燥空气中稳定,在湿空气中放出氨转化为NH4HC03,59时分解为NH3和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下列是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验.请观察如图的实验装置、分析实验原理,下列说法错误的是( )
下列是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验.请观察如图的实验装置、分析实验原理,下列说法错误的是( )| A、甲为纯碱,乙为小苏打 |
| B、要证明碳酸氢钠受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球 |
| C、整个实验过程中可以看到丙烧杯的澄清石灰水没变浑浊 |
| D、同质量的甲和乙完全反应消耗的同浓度的盐酸体积:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com