
����Ŀ�������� 0.1mol/L��H2A��Һ��H2A��HA-��A2-��������ռ���ʵ����������ֲ�ϵ������pH�仯�Ĺ�ϵ��ͼ��ʾ�����б�������ȷ����

A. HA-![]() H+ + A2- K=10-4.2
H+ + A2- K=10-4.2
B. �� 0.1mol/L NaHA ��Һ�У�������Ũ�ȴ�С��ϵΪ��c(Na+)��c(HA-)��c(H+)��c(A2-)��c(OH-)
C. ��֪25��ʱHF��Ka=10-3.45��������H2A����Һ��������NaF��Һ�У������ķ�ӦΪ��H2A+F���T HF+HA��
D. �������ʵ�����NaHA��Na2A����ˮ�У�������ҺpHǡ��Ϊ4.2
���𰸡�A
��������
A. H2A���ֵ��룬�ֲ����룬�Ե�һ������Ϊ��������뷽��ʽΪH2A![]() H++ HA������A����
H++ HA������A����
B.PH=4.2ʱ��HA����A2-Ũ����ȣ���Һ�����ԣ�˵��HA������̶ȴ���HA��ˮ��̶ȣ�����0.1mol/L NaHA ��Һ�У�������Ũ�ȴ�С��ϵΪ��c(Na+)��c(HA-)��c(H+)������ˮ�ĵ��룬��c(H+)��c(A2-)��c(OH-)�����Ը�����Ũ�ȴ�С��ϵΪc(Na+)��c(HA-)��c(H+)��c(A2-)��c(OH-)����B��ȷ��
C. ��֪25��ʱHF��Ka=10-3.45����������Ϣ��֪��K1= c(H+)��c(HA-)/c(H2A)=10-1.2��K2= c(H+)��c(A2-)/c(HA-)=10-4.2��������H2A>HF>HA-��������H2A����Һ����������NaF��Һ�У������ķ�ӦΪ��H2A+F���T HF+HA������C��ȷ��
D. �������ʵ�����NaHA��Na2A����ˮ�У�HA����A2-Ũ����ȣ�K2=c(H+)��c(A2-)/c(HA-)=10-4.2����c(H+)=10-4.2mol/L��pHΪ4.2����D��ȷ��
��ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�����ʵ�ֵ���

A. װ�âٿɼ��������鷢����ȥ��Ӧ�õ�������Ϊ��ϩ
B. װ�â��е�CuSO4��Һ�����ڳ�ȥ����
C. װ�â�a���к�ɫ�������ɣ�b��������֤��Xһ����H2
D. װ�âܿ�����ʵ������ȡ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ����250mL0.2mol��L��1Na2CO3����Һ��ʾ��ͼ��
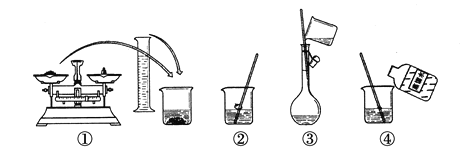
�ش��������⣺
��1��������ƿ��ʹ�÷����У����в�������ȷ����___(����ĸ)��
A��ʹ������ƿǰ������Ƿ�©ˮ
B������ƿ������ˮϴ�������ô�����Һ��ϴ
C��������Һʱ����������ǹ��壬�ѳƺõ�������ֽ��С�ĵ�������ƿ�У�������������ˮ���ӽ��̶���1��2 cm�����ý�ͷ�ιܵμ�����ˮ���̶���
D��������Һʱ�����������Һ�壬����Ͳ��ȡ������ֱ�ӵ�������ƿ�У�������������ˮ���ӽ��̶���1��2 cm�����ý�ͷ�ιܵμ�����ˮ���̶���
E���Ǻ�ƿ������ʳָ��סƿ��������һֻ����סƿ�ף�������ƿ��ת��ҡ�����
��2�����гƵ�Na2CO3___g��
��3���������ڢڡ��������е����÷ֱ���___��____��
��4�������������������������ҺŨ���к�Ӱ�죿(����ƫ������ƫ����������Ӱ����)
A��ijͬѧ�ڵڢಽ�۲�Һ��ʱ����____��
B���ڵڢݲ�����������Һ����������ƿ��____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A. ��ά�ء������͡���˿��һ�������¶��ܷ���ˮ�ⷴӦ
B. ú�ĸ����ǻ�ѧ�仯��ú��������Һ����ʯ�͵ķ����������仯
C. ��������ϵͳ����������Ϊ2��2-��������
D. ����������(![]() )��������(
)��������(![]() )�Ķ��ȴ�����Ŀ��ͬ
)�Ķ��ȴ�����Ŀ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���1L0.1mol��L��1NH4Cl��Һ�в��ϼ������NaOH��NH4+��NH3��H2O�ı仯��������ͼ��ʾ(����������仯�Ͱ��Ļӷ�)������˵������ȷ���ǣ� ��

A. M����Һ��ˮ�ĵ���̶ȱ�ԭ��ҺС
B. ��M��ʱ��n(OH��)��n(H+)=(a��0.05)mol
C. ����NaOH�ļ��룬![]() ��������
��������
D. ��n(NaOH)=0.05mo1ʱ����Һ���У�c(Cl��)> c(NH4+)>c(Na+)>c(OH��)>c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��һ����CO��H2Ϊԭ�Ϻϳɼ״����÷�Ӧ���Ȼ�ѧ����ʽΪ��CO(g)+ 2H2(g)![]() CH3OH(g) ��H
CH3OH(g) ��H
��1����֪CO(g)��H2(g)�ı�ȼ���ȷֱ�Ϊ-285.8kJmol-1��-283.0kJmol-1����CH3OH(g)+3/2O2(g)![]() CO2(g)+2H2O(l) ��H=��761 kJmol-1����CO(g)+ 2H2(g)
CO2(g)+2H2O(l) ��H=��761 kJmol-1����CO(g)+ 2H2(g)![]() CH3OH(g)�ġ�H= ___________��
CH3OH(g)�ġ�H= ___________��
��2����Ӧ�Ħ�S_______0�������������������������________����ϸߡ��ϵ͡����¶��¸÷�Ӧ�Է����С�
��3�����������ʵ�����CO��H2������������º����ܱ������н���������Ӧ��������ʵ��˵���˷�Ӧ�Ѵﵽƽ��״̬����_______________��
A�������������ܶȱ��ֲ��� B����������ƽ����Է�����������
C������CH3OH������������H2��������� D��CO������������ֲ���
��4����ͼ������ȷ��ӳƽ�ⳣ��K���¶ȱ仯��ϵ������Ϊ__________����a��b��ʾ����

��5��Ͷ�ϱ�n(H2)/n(CO)=2ʱ����ϵ��CO��ƽ��ת����(��)�¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ2��ʾ����(CO)ֵ���¶����߶�___________�������С������ԭ����___________________________����ͼ�е�ѹǿ�ɴ�СΪ__________________����P1��P2��P3��ʾ����

��6��520Kʱ�� Ͷ�ϱ�n(H2)/n(CO)=2�������ʵ���Ϊ3mol����ά�ַ�Ӧ������ѹǿP3���䣬�ﵽƽ��ʱ����������Ϊ0.1L����ƽ�ⳣ��K=_______����H2��CO�����ʵ���֮��Ϊn��1��ά�ַ�Ӧ������ѹǿP3���䣩����Ӧƽ����ϵ��CH3OH�����ʵ�������Ϊx��������ͼ�л���x��n�仯��ʾ��ͼ_______��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������̫���ܵ���е������ྦྷ��̫���ܵ�ء�GaAs̫���ܵ�ؼ�ͭ��������Ĥ̫���ܵ�صȡ���ش��������⣺
��1����̬��ԭ�ӵļ۵����Ų�ʽΪ___��H2O�ķе����H2Se�ķе�(��42��)����ԭ����___��
��2����֪GaCl3�����۵�Ϊ77.9�棬�е�Ϊ201.3�棬GaCl3Ʒ������Ϊ____��
��3��Na3AsO4�������ӵĿռ乹��Ϊ_____��Asԭ�Ӳ�ȡ_____�ӻ���
��4��������CuO����ת��ΪCu2O���Դ�ԭ�ӽṹ�ǶȽ���ԭ��_____��
��5��п��ͭλ��ͬһ���ڡ���п�ľ����ṹ��ͼ��ʾ��S2����Χ�Ⱦ����������Zn2+����Ϊ____���������߳�Ϊdpm������п���ܶ�Ϊ____g��cm��3(���ؼ�)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������մɵ������Ļ��塢���Ϻʹ�������������(��Ҫ��Sn��Sb��As��Pb��������)Ϊԭ�ϣ��Ʊ������ƵĹ�������ͼ���£�

��ش��������⣺
��1��Sn(��A)��As(VA)��Sb(VA)����Ԫ���У�As��Sb��������ϼ�Ϊ___________��Sn��ԭ������Ϊ50����ԭ�ӽṹʾ��ͼΪ___________��
��2������Һ�еõ������ƾ����ʵ�������___________�����ȹ��ˡ����
��3���������ʱ����SnO�����ϸߣ���ҵ�������NaNO3����������______________________����ͼ���������ʵ��IJ�������ѡ����������ĺ�������_________________________________��

��4������Ǧ���ǴӺ�Na2PbO2����Һ���γ���Ǧ���������ӷ���ʽΪ_________________��
��5����������ʱ�����Ļ�ѧ����ʽΪ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������У��뾶���ɴ�С����˳����ȷ����
�ٻ�̬X��ԭ�ӽṹʾ��ͼ
�ڻ�̬Y�ļ۵����Ų�ʽ��3s23p5
�ۻ�̬Z2���ĵ����Ų�ͼ![]()
��W��̬ԭ����2���ܲ㣬����ʽΪ![]()
A. ��>��>��>�� B. ��>��>��>��
C. ��>��>��>�� D. ��>��>��>��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com