
【题目】某实验小组欲探究醛的银镜反应用银氨溶液而不直接用AgNO3溶液的原因。
(一)甲同学进行了如下对比实验:
装置 | 实验序号 | 试管中的药品 | 现象 |
| 实验Ⅰ | 2%AgNO3溶液1mL,加入2%氨水22滴;再加入3滴新开瓶的40%的乙醛溶液;水浴加热3分钟 | 光亮的银镜 |
实验Ⅱ | 2%AgNO3溶液1mL,加入3滴新开瓶的40%的乙醛溶液;水浴加热3分钟 | 无明显现象 |
(1)乙醛发生银镜反应的化学方程式为_____。
(2)甲同学认为:2%AgNO3溶液应该比用其配制的银氨溶液更易氧化乙醛,可能的理由是_____(写出一条即可);而实验Ⅱ中无明显现象,从化学反应原理的角度解释可能的原因_____(写出一条即可)。
(二)乙同学为了找到银镜反应用银氨溶液的真正原因,先查阅资料,发现醛银镜反应的机理分为如下三步:

(3)据此,乙设计了更好的银镜实验III:2%AgNO3溶液1mL,加入3滴1mol/LNaOH溶液,再加入2%氨水22滴;再加入3滴新开瓶的40%的乙醛溶液;水浴加热,很快出现了银镜。
(4)乙根据实验III并结合反应机理中出现银镜的分步机理(3),得出的结论是_____。
(三)丙同学为了确认AgNO3溶液能氧化醛,继续查找资料,找到了不同浓度的AgNO3溶液对室内HCHO气体去除效果如图。
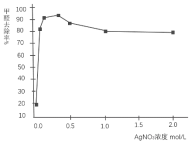
(5)从图中可见:AgNO3溶液浓度达到一定程度,HCHO的去除率基本不变,原因是AgNO3溶液浓度越高,酸性越强,降低了______的还原性;同时,说明了AgNO3溶液和HCHO反应的氧化剂不是______。
(四)结合甲乙丙的实验和资料,丁同学进一步提出,溶液的pH稳定,有利于快速形成均匀光亮的银镜。
(6)请结合化学用语解释AgNO3溶液与乙醛溶液的反应pH变化明显,而银氨溶液变化不明显_____。
(7)综合该实验小组四位同学的实验和论证,最后得出银镜反应用银氨溶液,而不是AgNO3溶液的优点是_____(写出2条即可)。
【答案】CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+2Ag↓+3NH3+H2O Ag+浓度大,氧化性强或酸性条件下,Ag+氧化性强或NO3—也可做氧化剂 酸性条件下,乙醛还原性弱或能发生银镜反应,但速率太慢 增强碱性(OH-浓度),可加快生成银镜的反应速率 HCHO NO3— CH3CHO+H2O+2AgNO3
CH3COONH4+2Ag↓+3NH3+H2O Ag+浓度大,氧化性强或酸性条件下,Ag+氧化性强或NO3—也可做氧化剂 酸性条件下,乙醛还原性弱或能发生银镜反应,但速率太慢 增强碱性(OH-浓度),可加快生成银镜的反应速率 HCHO NO3— CH3CHO+H2O+2AgNO3![]() CH3COOH+2Ag↓+2HNO3,pH减小,影响银镜生成;而(1)中银氨溶液反应碱性基本不变(或者说NH3—NH
CH3COOH+2Ag↓+2HNO3,pH减小,影响银镜生成;而(1)中银氨溶液反应碱性基本不变(或者说NH3—NH![]() 缓冲溶液体系) 银氨溶液溶液呈碱性,醛类还原性增强;或银氨溶液溶液呈碱性,硝酸根的氧化性减弱;或银氨溶液呈碱性,氢氧根浓度大,生成银镜反应速率快;或反应生成乙酸铵和氨气,可使反应体系pH变化不大
缓冲溶液体系) 银氨溶液溶液呈碱性,醛类还原性增强;或银氨溶液溶液呈碱性,硝酸根的氧化性减弱;或银氨溶液呈碱性,氢氧根浓度大,生成银镜反应速率快;或反应生成乙酸铵和氨气,可使反应体系pH变化不大
【解析】
(1)乙醛和银氨溶液在水浴加热条件下发生氧化还原反应生成乙酸铵、氨气、银和水;
(2)由乙醛和银氨溶液反应的化学方程式可知,反应中银元素化合价升高被还原,说明银镜反应与银离子浓度大小、溶液酸碱性和硝酸根有关;由实验现象可知,酸性条件不利于银镜生成;
(4)根据实验III并结合反应机理中出现银镜的分步机理(3)可知,溶液中氢氧根浓度增大,加快了[AgH]与Ag+的反应速率,可加快生成银镜的反应速率;
(5)由图可知,AgNO3溶液浓度越高,酸性越强,降低了甲醛的还原性,同时说明反应中硝酸根没有参与反应;
(6)乙醛与硝酸银溶液共热反应生成乙酸、硝酸和银,反应中生成乙酸和硝酸,溶液酸性增强,pH减小,影响银镜生成,而乙醛与银氨溶液反应生成乙酸铵和氨气,形成了NH3—NH![]() 缓冲溶液体系,使溶液碱性基本不变,有利于银镜生成;
缓冲溶液体系,使溶液碱性基本不变,有利于银镜生成;
(7)与AgNO3溶液相比,银氨溶液具有溶液呈碱性,增强了醛类还原性、降低了硝酸根的氧化性;溶液中氢氧根浓度大,生成银镜反应速率快;反应生成乙酸铵和氨气,形成了NH3—NH![]() 缓冲溶液体系,使溶液碱性基本不变,有利于银镜生成等优点
缓冲溶液体系,使溶液碱性基本不变,有利于银镜生成等优点
(1)乙醛和银氨溶液在水浴加热条件下发生氧化还原反应生成乙酸铵、氨气、银和水,反应的化学方程式为CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+2Ag↓+3NH3+H2O,故答案为:CH3CHO+2Ag(NH3)2OH
CH3COONH4+2Ag↓+3NH3+H2O,故答案为:CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+2Ag↓+3NH3+H2O;
CH3COONH4+2Ag↓+3NH3+H2O;
(2)由乙醛和银氨溶液反应的化学方程式可知,反应中银元素化合价升高被还原,甲同学认为2%AgNO3溶液应该比用其配制的银氨溶液更易氧化乙醛的理由是2%AgNO3溶液中Ag+浓度比银氨溶液中Ag+浓度大,氧化性更强,或2%AgNO3溶液中Ag+水解使溶液呈酸性,酸性条件下,Ag+氧化性强,或2%AgNO3溶液中含有具有氧化性的NO3—,NO3—也可氧化乙醛;由题意可知实验Ⅰ为碱性条件,有银镜生成,实验Ⅱ为酸性条件,无银镜生成,说明酸性条件下,乙醛还原性比碱性条件弱,不能发生银镜反应,或酸性条件下也能发生银镜反应,但速率太慢,无法观察到银镜,故答案为:Ag+浓度大,氧化性强或酸性条件下,Ag+氧化性强或NO3—也可做氧化剂;酸性条件下,乙醛还原性弱或能发生银镜反应,但速率太慢;
(4)根据实验III并结合反应机理中出现银镜的分步机理(3)可知,溶液中氢氧根浓度增大,加快了[AgH]与Ag+的反应速率,可加快生成银镜的反应速率,故答案为:增强碱性(OH-浓度),可加快生成银镜的反应速率;NO3—;
(5)由图可知,AgNO3溶液浓度达到一定程度,HCHO的去除率基本不变,原因是AgNO3溶液浓度越高,酸性越强,降低了甲醛的还原性,同时说明反应中硝酸根没有参与反应,说明甲醛与硝酸银反应时,硝酸根不是反应的氧化剂,故答案为:HCHO;NO3—;
(6)乙醛与硝酸银溶液共热反应生成乙酸、硝酸和银,反应的化学方程式为CH3CHO+H2O+2AgNO3![]() CH3COOH+2Ag↓+2HNO3,反应中生成乙酸和硝酸,溶液酸性增强,pH减小,影响银镜生成,而乙醛与银氨溶液反应生成乙酸铵和氨气,形成了NH3—NH
CH3COOH+2Ag↓+2HNO3,反应中生成乙酸和硝酸,溶液酸性增强,pH减小,影响银镜生成,而乙醛与银氨溶液反应生成乙酸铵和氨气,形成了NH3—NH![]() 缓冲溶液体系,使溶液碱性基本不变,有利于银镜生成,故答案为:CH3CHO+H2O+2AgNO3
缓冲溶液体系,使溶液碱性基本不变,有利于银镜生成,故答案为:CH3CHO+H2O+2AgNO3![]() CH3OOH+2Ag↓+2HNO3,pH减小,影响银镜生成;而(1)中银氨溶液反应碱性基本不变(或者说NH3—NH
CH3OOH+2Ag↓+2HNO3,pH减小,影响银镜生成;而(1)中银氨溶液反应碱性基本不变(或者说NH3—NH![]() 缓冲溶液体系);
缓冲溶液体系);
(7)由该实验小组四位同学的实验和论证可知,与AgNO3溶液相比,银氨溶液具有溶液呈碱性,增强了醛类还原性、降低了硝酸根的氧化性;溶液中氢氧根浓度大,生成银镜反应速率快;反应生成乙酸铵和氨气,形成了NH3—NH![]() 缓冲溶液体系,使溶液碱性基本不变,有利于银镜生成等优点,故答案为:银氨溶液溶液呈碱性,醛类还原性增强;银氨溶液溶液呈碱性,硝酸根的氧化性减弱;银氨溶液呈碱性,氢氧根浓度大,生成银镜反应速率快;反应生成乙酸铵和氨气,可使反应体系pH变化不大。
缓冲溶液体系,使溶液碱性基本不变,有利于银镜生成等优点,故答案为:银氨溶液溶液呈碱性,醛类还原性增强;银氨溶液溶液呈碱性,硝酸根的氧化性减弱;银氨溶液呈碱性,氢氧根浓度大,生成银镜反应速率快;反应生成乙酸铵和氨气,可使反应体系pH变化不大。


科目:高中化学 来源: 题型:
【题目】具有以下分子式的一溴代烷的所有同分异构体,水解后的产物,经催化氧化最多生成4种醛,则该一溴代烷的分子式可能是( )
A.C6H13BrB.C5H11BrC.C4H9BrD.C3H7Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )

A. y轴表示的可能是第一电离能
B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径
D. y轴表示的可能是原子形成简单离子转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)指出如图实验装置中的错误之处(加热装置中烧杯底部已垫有石棉网)
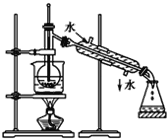
①___;②___。
(2)图是某学生的过滤操作示意图,其操作不规范的是___。
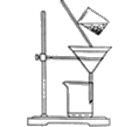
a.漏斗下口尖端未紧靠烧杯壁 b.玻璃棒有引流作用
c.将滤纸湿润,使其紧贴漏斗壁 d.滤纸边缘低于漏斗口边缘
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组在电压为24V时进行如下实验,电解3分钟后,发现下列现象。
编号 | ① | ② | ③ |
装置 |
|
|
|
现象 | 小灯泡微弱发光,两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 | 两极均产生气泡,溶液无明显变化 | 两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 |
下列说法正确的是( )
A.①中小灯泡微亮是因为Ca(OH)2是弱电解质
B.对比①和②,白色浑浊的出现与电极材料无关
C.对比①和③,白色浑浊是由于OH-迁移到阳极使Ca(OH)2沉淀析出
D.阳极附近白色沉淀的成分可能是CaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是工业生产中不可缺少的一种金属。请回答下列问题:
(1)Fe元素在元素周期表中的位置是__。
(2)Fe有δ、γ、α三种同素异形体,其晶胞结构如图所示:
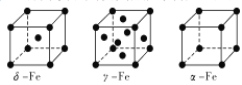
①δ、α两种晶体晶胞中铁原子的配位数之比为__,γ晶胞中实际拥有___个原子。
②若Fe原子半径为rpm,NA表示阿伏加德罗常数的值,则δ-Fe单质的密度为___g/cm3(列出算式即可)。
(3)三氯化铁在常温下为固体.熔点为282℃,沸点为315℃,在300℃以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体类型为___。
(4)氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示。
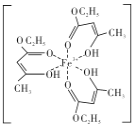
①此配合物中碳原子的杂化轨道类型有___。
②此配离子中含有的化学键有___(填字母代号)。
A.离子键 B.金属键 C.极性键 D.非极性键
E.配位键 F.氢键 G.δ键 H.π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1mL1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述不正确的是
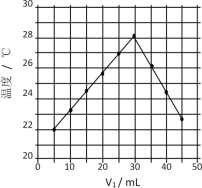
A.做该实验时环境温度低于22℃
B.该实验表明化学能可能转化为热能
C.该实验表明有水生成的反应一定是放热反应
D.NaOH溶液的浓度约为1.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g) +H2O(g)。在610 K时,将0.10molCO2与0.40molH2S充入2.5L的空钢瓶中,反应平衡后水蒸汽的物质的量分数为0.02。则H2S的平衡转化率为____%,反应平衡常数K=____(保留小数点后两位)。
COS(g) +H2O(g)。在610 K时,将0.10molCO2与0.40molH2S充入2.5L的空钢瓶中,反应平衡后水蒸汽的物质的量分数为0.02。则H2S的平衡转化率为____%,反应平衡常数K=____(保留小数点后两位)。
Ⅱ、某学生用0.200mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下滴定管液面读数
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是____(填编号)。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入___中(从图中选填“甲”或“乙”)。

(3)下列操作会引起实验结果偏大的是:____(填编号)。
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,滴定管尖嘴有气泡,滴定后无气泡
C.滴定终点俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组同学研究 Cu与H2SO4 溶液反应,小伟同学实验记录如下:
实验编号 | 实验操作 | 实验现象 |
Ⅰ | 取螺旋状铜丝在酒精灯上烧至红热,迅速伸入装有 10 mL 3 mol/L H2SO4溶液的试管中 | 产生大量白雾;溶液颜色变为浅蓝色;试管中出现红色浑浊 |
Ⅱ | 步骤一:取螺旋状铜丝在酒精灯上烧至红热, 迅速伸入装有10 mL蒸馏水的试管中; 步骤二:冷却后加入5 mL 3 mol/L H2SO4 | 步骤一:产生少量白雾;试管中出现黑色浑浊,略带红色 步骤二:浑浊全部为红色;溶液略显蓝色 |
(1)实验一:探究白雾的成分
①波波同学收集实验Ⅰ中白雾,加入品红溶液,溶液褪色,得出结论:白雾成分包含 SO2。可能是因为局部温度过高产生,写出有关化学方程式 ________。
②艳艳同学认为不妥,补充实验Ⅲ:
实验编号 | 实验操作 | 实验现象 |
Ⅲ | 步骤一:取品红溶液,加 3 mol/L H2SO4溶液,加热; 步骤二:收集实验Ⅰ中白雾,加入品红溶液,加热 | 步骤一:溶液褪色,加热无颜色变化; 步骤二:溶液褪色,加热无颜色变化 |
根据实验Ⅲ,可推断白雾成分是______,而并非SO2。
(2)实验二:探究红色固体的成分。经过分析,实验Ⅰ和实验Ⅱ中的红色浑浊成分相同。
(资料)Cu2O能溶在浓氨水中形成无色Cu(NH3)2+,很容易被氧气氧化为蓝色Cu(NH3)22+;Cu2O能与一定浓度的酸溶液发生反应:Cu2O+2H+=Cu2++Cu+H2O。
①写出Cu2O溶在浓氨水中的离子方程式 _______。
②对于红色浑浊的成分,谷哥设计实验并实施,证实了红色固体中只有Cu2O。他的实验是:将实验Ⅰ试管中固体过滤洗涤,得红色固体,__________。
③结合实验Ⅰ和Ⅱ,吉吉同学确定铜丝烧至红热时生成了______。
(3)实验三:探究红色固体不溶的原因。经过检验,实验Ⅰ和实验Ⅱ反应后的溶液均显酸性,对于体系中有Cu2O固体的原因:
龙校假设:在实验条件下,随着溶液酸性降低,Cu2O与酸无法反应。
乔博假设:在实验条件下,随着溶液酸性降低,Cu2O与酸反应速率变小。
邹邹同学继续实验:
实验编号 | 实验操作 | 实验现象 |
Ⅳ | 取Cu2O固体少量,加入到装有 10 mL3 mol/L H2SO4 溶液的试管中 | 溶液迅速变为蓝色;试管中出现少量亮红色固体 |
Ⅴ | 取Cu2O固体少量,加入到装有 10 mL 3 mol/L H2SO4 和少量CuSO4 (浅蓝色)的试管中 | 现象同Ⅳ |
Ⅵ | 重复实验Ⅰ,振荡试管,分为两等份。第一份立刻加入浓硫酸至 c(H2SO4)=3 mol/L;第二份静置 4 h之后,过滤,向固体中加入浓硫酸至 c(H2SO4)=3 mol/L | 第一份加酸后红色固体明显减少,溶液蓝色加深;第二份静置时,固体减少,溶液缓慢变为蓝色,固体加酸后无明显现象。 |
①实验Ⅴ的目的是 ______。
②通过以上实验,臧臧同学得出的结论是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com