
 5C(g),起始时4个容器所盛A2和B2的量如下表所示:
5C(g),起始时4个容器所盛A2和B2的量如下表所示:| 容量 | 甲 | 乙 | 丙 | 丁 |
| A2(mol) | 2 | 1 | 2 | 1 |
| B2(mol) | 1 | 1 | 2 | 2 |
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源:不详 题型:填空题
 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
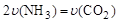 B.密闭容器中总压强不变
B.密闭容器中总压强不变 NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。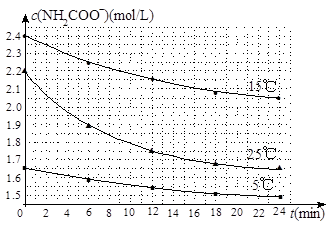
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题: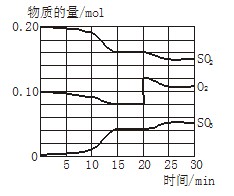
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Q1+ Q2 + Q3 | B.0.5 Q3-Q2+2Q1 |
| C.0.5 Q3+ Q2-2Q1 | D.0.5(Q1+Q2+Q3) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO3(g),△H<0。反应过程中SO2、O2、SO3物质的量变化如图所示:
2SO3(g),△H<0。反应过程中SO2、O2、SO3物质的量变化如图所示: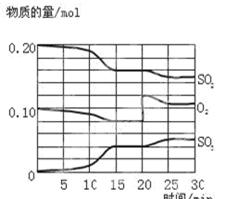
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Na2S(s)+4H2O(g),△H<0,在恒温恒容时回答以下问题:
Na2S(s)+4H2O(g),△H<0,在恒温恒容时回答以下问题:
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 2NH3。达到平衡后,测得反应放出的热量为18.4 kJ,混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%。
2NH3。达到平衡后,测得反应放出的热量为18.4 kJ,混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 p C在某温度下达到平衡。
p C在某温度下达到平衡。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H2(g)+I2(g),H2物质的量随时间的变化如图所示。
H2(g)+I2(g),H2物质的量随时间的变化如图所示。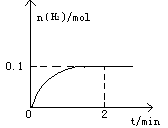
 2HI(g)的平衡常数K= 。
2HI(g)的平衡常数K= 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com