
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分。当左边充入2molN2,右边充入CO和CO2的混合气体共18g时,隔板处于如图位置(左、右两侧温度相同)。右侧CO2与CO分子数之比为( )
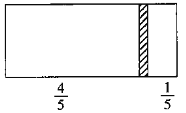
A.3:1B.1:1C.1:2D.1:3
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】金属钒被誉为“合金的维生素”。从废钒(主要成分为V2O5、Fe2O3、SiO2等)中回收V2O5的一种工艺流程如下图所示:

已知:
步骤②、③中的变化过程可简化为:Rn+(水层)+nHA(有机层)![]() RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
回答下列问题:
(1)步骤D酸浸过程中发生氧化还原反应的化学方程式为______________________。
(2)萃取时应加入适量碱的作用是___________________。
(3)步骤④中反应的离子方程式为___________________。
(4)步骤⑤加入氨水调节溶液pH=2,钒沉淀率达到93%且不产生Fe(OH)3沉淀,则此时溶液中c(Fe3+)<_____mol/L(按25℃计算,25℃时Ksp[Fe(OH)3]=2.6×10-39)。所得NH4VO3为离子化合物,NH4+的电子式为_______。
(5)V2O5是两性氧化物,在强酸性溶液中以VO2+形式存在,VO2+具有强氧化性,能将I-氧化为I2,本身被还原为V0+,则V2O5与氢碘酸反应的离子方程式为_________________。
(6)为提高钒的回收率,步骤②和③需多次进行,假设酸浸所得“强酸性浸出液”中c(VO2+)=amol/L,步骤②和③每进行一次,VO2+萃取率为80%,4次操作后,“强酸性浸出液中”c(VO2+)=_______mol/L(萃取的量=![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物(NOx)是大气污染物之一。工业上在一定的温度和催化剂条件下,可用NH3来消除NOx的污染,生成两种对环境无害的物质。
(1)请写出NH3与NO2反应的化学方程式____。
(2)①写出实验室中由固体物质制取氨气的化学方程式__;
②欲收集一瓶干燥的氨气,选择下图中的装置,其连接顺序为:发生装置→____(按气流方向,用小写字母表示)
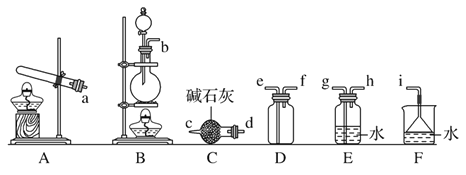
(3)电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益。实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极)。若用NO2气体进行模拟电解法吸收实验。

①写出电解时NO2发生反应的电极反应式:___。
②若有标准状况下2.24LNO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+为__mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】傅克反应是合成芳香族化合物的一种重要方法。有机物a和苯通过傅克反应合成b的过程表示如下(无机小分子产物略去):
![]() 下列说法中不正确的是
下列说法中不正确的是
A. 该反应是取代反应
B. 若R为CH3时,a的电子式为![]()
C. 若R为C4H9时,b的结构可能有4种
D. 若R为C4H5O时,1molb最多可与5molH2加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
A | B | C | D | |
实验 | 制取少量纯净的CO2气体 | 用CCl4提取溴水中的Br2 | 除去CO2中少量的HCl | 蒸干NaCl饱和溶液制备NaCl晶体 |
装置或仪器 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是在一定温度下向不同电解质溶液中加入新物质时其电流强度(I)随新物质加入量(V)的变化曲线。(假设混合溶液体积等于二者体积之和)下列说法正确的是( )
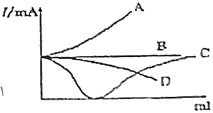
A.向醋酸溶液中逐滴加入等浓度的氨水至恰好完全反应
B.向Ba(OH)2溶液中逐滴加入等浓度的H2SO4至过量
C.向盐酸溶液中逐滴加入等浓度的NaOH溶液过量
D.向氨水中滴加浓硝酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒元素(Se)是第4周期ⅥA族元素,单质有红硒、黑硒和灰硒,灰硒是良好的半导体材料,硒最特殊的性质是在光照射下导电性可提高近千倍,可用于制造光电管。请回答下列问题:
(1)基态Se原子价电子的轨道表示式为__。
(2)As和Se是同一周期元素,As的第一电离能比Se大,原因是___。
(3)硒在空气中燃烧能生成SeO2,常温下,SeO2是易挥发的白色固体,熔点为340~350℃,315℃时升华,则SeO2固体是___晶体;写出一种与SeO2互为等电子体的阴离子的化学式__。
(4)H2SeO4和H2SO4相似,是一种不易挥发的强酸。SeO42-的空间构型为___,中心原子的杂化方式为___。
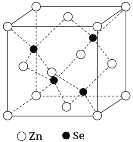
(5)硒化锌是一种重要的半导体材料,其晶胞结构如图所示,Zn原子的配位数为___,若该晶胞密度为ρg·cm-3,硒化锌的摩尔质量为Mg·mol-1,用NA代表阿伏加德罗常数,则晶胞参数a(即晶胞的边长)为___nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品香精菠萝酯的生产路线(反应条件略去)如下:

下列叙述错误的是( )
A.步骤(1)产物中残留的苯酚可用FeCl3溶液检验
B.苯酚和菠萝酯均可与酸性KMnO4溶液发生反应
C.苯氧乙酸和菠萝酯均可与NaOH溶液发生反应
D.步骤(2)产物中残留的丙烯醇可用溴水检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活与健康,某地区的雾霾中可能含有如下可溶性无机离子:Na+、![]() 。某同学收集了该地区的雾霾,经必要的预处理后配成试样溶液,设计并完成了如下的实验:①取试样溶液100mL,向其中加入足量BaCl2溶液,得到白色沉淀2.33g,滴入足量盐酸沉淀质量不变。②另取试样溶液100mL,向其中加入足量NaOH溶液,得到白色沉淀1.16g.再滴入足量盐酸沉淀全部溶解。
。某同学收集了该地区的雾霾,经必要的预处理后配成试样溶液,设计并完成了如下的实验:①取试样溶液100mL,向其中加入足量BaCl2溶液,得到白色沉淀2.33g,滴入足量盐酸沉淀质量不变。②另取试样溶液100mL,向其中加入足量NaOH溶液,得到白色沉淀1.16g.再滴入足量盐酸沉淀全部溶解。
(1)实验①能确定该雾霾中肯定不含的离子为_______________________。
(2)判断Cl-是否存在,若存在求其最小浓度(若不存在说明理由)________。
(3)该雾霾中肯定含有的离子为_________________________。
(4)1.16g白色沉淀为________(写化学式)。
(5)反应中消耗的BaCl2的物质的量为________mol。
(6)操作②中加盐酸沉淀溶解的离子方程式为______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com