
【题目】已知有以下物质相互转化
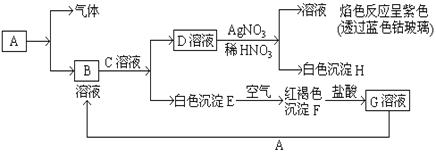
(1)A转化为B及气体这步反应中应加入的试剂是_______(填名称)。
(2)写出B的化学式_______ D的化学式_______
(3)写出由E转变成F的化学方程式_____________________________
(4)写出向G溶液中加入A的有关离子反应方程式是______________________。
【答案】 盐酸 FeCl2 KCl )4Fe(OH)2 +O2+2H2O=4Fe(OH)3 2Fe3++Fe=3Fe2+
【解析】由图中信息可知,白色沉淀E在空气中易转化为红褐色的沉淀F,所以E和F分别为氢氧化亚铁和氢氧化铁,G为氯化铁;D溶液可与硝酸银反应生成不溶于稀硝酸的白色沉淀,说明该沉淀是氯化银,说明溶液B、D中含氯离子;由焰色反应呈紫色,推出溶液C为氢氧化钾。综合以上信息,可推出A为铁,其与盐酸反应生成氯化亚铁溶液和氢气。
(1)A转化为B及气体这步反应中应加入的试剂是盐酸。
(2)B的化学式FeCl2、 D的化学式KCl。
(3)由E转变成F的化学方程式4Fe(OH)2 +O2+2H2O=4Fe(OH)3 。
(4)向氯化铁溶液中加入铁可以生成氯化亚铁,离子反应方程式是2Fe3++Fe=3Fe2+。


科目:高中化学 来源: 题型:
【题目】化学与社会、生活密切相关,下列说法正确的是
A. 通过浸渍水玻璃的方法防止木材腐朽
B. 宣纸的主要成分为蛋白质,酸性条件下易水解
C. 地沟油的主要成分与柴油的主要成分相同,所以地沟油可用于制生物柴油
D. SO2有毒,不能用作食品漂白剂和食品防腐剂添加在粉条、红酒等食品饮料中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将190 g MgCl2溶于水配制成1 L溶液。
(1)该溶液中MgCl2的物质的量浓度为________,溶液中Cl的物质的量浓度为________。
(2)配制1 mol/L的MgCl2溶液500 mL,需该溶液的体积为________。
(3)向(2)中500 mL溶液中再通入一定量的HCl气体后,溶液中Cl的浓度为3 mol·L1(假设溶液体积不变),则溶液中H+的物质的量浓度为_____, 通入HCl气体的体积(标况下)为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组通过灼烧法测定CuxSy的组成,并验证气体产物SO2的部分性质,设计实验如下(夹持装置略去):
I.测定CuxSy的组成

步骤一:用上图所示装置高温灼烧16.0gCuxSy至固体质量不再变化,停止加热,继续通入O2至硬质玻璃管冷却。
步骤二:向装置D所得溶液中加入足量双氧水,再加入过量BaCl2溶液;将生成的沉淀过滤、洗涤、干燥、称量得沉淀质量为23.3 g。
(1)装置C中用于加热的仪器名称为___________________。
(2)步骤一中,停止加热后,继续通入O2的主要作用为___________________。
(3)由实验数据推断得CuxSy的化学式为___________________。
(4)若无装置E,则所测x∶y的值 ________(填“偏大”“ 偏小”或“无影响”)。.
Ⅱ.该小组选用实验I中的装置A、B、C和下图所示装置,依次验证SO2的漂白性,氧化性和还原性。

(5)按气流方向,装置的合理连接顺序为A→B→C→______________(填装置字母)。
(6)试剂X的名称为_____________。能证明SO2有还原性的实验现象为______________。
(7)装置G中发生反应的离子方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向100 mL一定浓度的草酸(H2C2O4)溶液中加入0.1mol·L-1NaOH 溶液,溶液的pH随NaOH溶液体积的变化曲线如图所示。下列有关说法正确的是

A. a点溶液的pH=2,草酸溶液的浓度为0.005 mol ·L-1
B. b点对应溶液中:c(Na+)>c(HC2O4-)>c(OH-)>c(C2O42-)
C. b→c段,反应的离子方程式为HC2O4- +OH-=C2O42-+H2O
D. c→d段,溶液中C2O42-的水解程度逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定体积的密闭容器中发生下列反应:2HI(g)![]() H2(g)+I2(g)。若c(HI)由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么c(HI)由0.07mol·L-1降到0.05 mol·L-1时,所需反应的时间为( )
H2(g)+I2(g)。若c(HI)由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么c(HI)由0.07mol·L-1降到0.05 mol·L-1时,所需反应的时间为( )
A.等于Ss B.等于10 s C.大于10 s D.小于10 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。请回答下列问题:

(1)以下叙述中,正确的是__________。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
F. 乙溶液中SO42-向铜片方向移动
(2)变化过程中能量转化的主要形式是:甲为__________;乙为__________。
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是______________________________________________。
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式及总反应离子方程式:铜电极: __________________,总反应: ________________________________。
当电路中转移0.25 mol电子时,消耗负极材料的质量为________________ (Zn的相对原子质量65)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com