
分析 (1)O3和O2都是由氧原子构成的单质分子,质量比等于氧原子的量之比;根据阿伏伽德罗定律,气体体积比等于气体物质的量之比,由此分析解答;
(2)1mol Na2X中含有2mol钠离子,0.2molNa2X中含有0.4 mol钠离子,则Na2X为,M(Na2X)=$\frac{m}{n}$计算求解;摩尔质量数值上等于相对式量,所以X的相对原子质量=62-46=16.
解答 解:(1)O3和O2都是由氧原子构成的单质分子,质量比等于氧原子的量之比,2molO3氧原子的物质的量为2mol×3=6mol,而3molO2氧原子的物质的量为3mol×2=6mol,所以2mol O3和3mol O2的质量之比1:1;气体体积比等于气体物质的量之比即为 2:3,故答案为:1:1; 2:3;
(2)1mol Na2X中含有2mol钠离子,0.2molNa2X中含有0.4 mol钠离子,则Na2X为,M(Na2X)=$\frac{12.4g}{0.2mol}$=62 g•mol-1;X的相对原子质量=62-46=16,故答案为:62 g•mol-1;16.
点评 本题考查物质的量有关计算,难度不大,注意掌握以物质的量为中心的计算公式及灵活应用.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 2H2+O2═H2O | B. | NH3+HCl═NH4Cl | ||
| C. | 4Fe(OH)2+2H2O+O2═4Fe(OH)3 | D. | 2Na2O2+2H2O═4NaOH+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2+X2═2HX | B. | X2+H20═HX+HXO | ||
| C. | NaX+AgNO3═AgX↓+NaNO3 | D. | 2NaX+H2SO4(浓)═Na2SO4+2HX |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
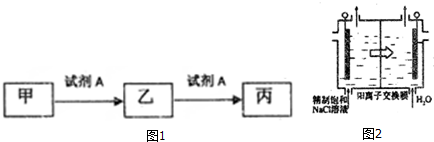
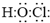 .二氧化氯还能溶于强碱溶液,该过程中发生反应生成等物质的量的氯酸钠(NaClO3)和另一种氯的含氯酸盐,同时生成水,该反应的离子方程式为2ClO2+2OH-═ClO3-+ClO2-+H2O
.二氧化氯还能溶于强碱溶液,该过程中发生反应生成等物质的量的氯酸钠(NaClO3)和另一种氯的含氯酸盐,同时生成水,该反应的离子方程式为2ClO2+2OH-═ClO3-+ClO2-+H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
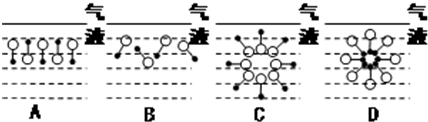
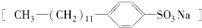 是常用洗涤剂的主要成分.其结构可用图形
是常用洗涤剂的主要成分.其结构可用图形 来表示,•端为链烃基,O端为极性基.根据这一结构特点,试分析和回答下列问题:
来表示,•端为链烃基,O端为极性基.根据这一结构特点,试分析和回答下列问题:
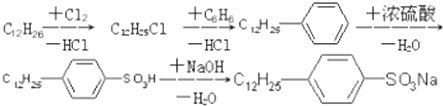
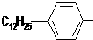 .
.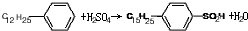 ,反应类型为取代反应.
,反应类型为取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图①中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0;使用和未使用催化剂时,反应过程中的能量变化 | |
| B. | 图②表示25℃时,用0.01mol•L-1盐酸滴定一定体积的0.01mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| C. | 图③表示CH4(g)+H2O(g)?CO(g)+3H2(g)△H,反应CH4的转化率与温度、压强的关系,且P1>P2、△H>0 | |
| D. | 图④中曲线表示反应2SO2(g)+O2(g)?2SO3(g)△H<0;正、逆反应的平衡常数K随温度的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不同元素的原子发生跃迁时,会释放不同的光 | |
| B. | 第一电离能与电负性的数值都是以气态中性基态原子为研究对象测得到 | |
| C. | 分子中的原子有固定的空间位置,组成完全相同的分子,由于原子位置的不同会表现出不同的性质 | |
| D. | 两个相同的原子的任意未成对电子的电子云在两个原子核间重叠,形成非极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:H2SO3?HSO${\;}_{3}^{-}$+H+ Ka1、HSO${\;}_{3}^{-}$?SO${\;}_{3}^{2-}$+H+ Ka2
已知:H2SO3?HSO${\;}_{3}^{-}$+H+ Ka1、HSO${\;}_{3}^{-}$?SO${\;}_{3}^{2-}$+H+ Ka2| A. | 曲线3表示的微粒是SO32- | |
| B. | 溶液pH=4.2时,c(Na+)+c(H+)=c(OH-)+2c(SO32-) | |
| C. | 常温下,$\frac{{K}_{a1}}{{K}_{a2}}$=1000 | |
| D. | 溶液pH=1.2时:c(Na+)+c(H+)=c(OH-)+c(HSO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 2 | B. | 3 | C. | 5 | D. | 6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com