
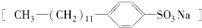 是常用洗涤剂的主要成分.其结构可用图形
是常用洗涤剂的主要成分.其结构可用图形 来表示,•端为链烃基,O端为极性基.根据这一结构特点,试分析和回答下列问题:
来表示,•端为链烃基,O端为极性基.根据这一结构特点,试分析和回答下列问题: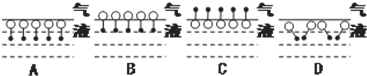
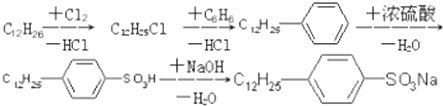
 .
.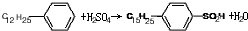 ,反应类型为取代反应.
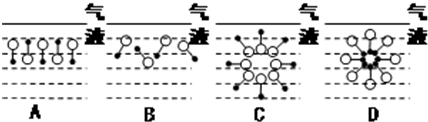
,反应类型为取代反应.分析 (1)分子的极性基(O端)应溶解于水(亲水基),链烃基(•端)不应溶解于水(憎水基);
(2)A中极性基交替排列,可减少分子之间的斥力;D中极性基(O端)向外、链烃基(•端)向内的排列,在一定程度上使憎水基团脱离与水的接触;
(3)烃基苯基是亲油基;
(4)十二烷基苯与硫酸反应生成对十二烷基苯磺酸;
(5)发挥催化作用需要适宜的条件,酶自身是蛋白质在不适宜的条件下容易变质;
(6)三聚磷酸钠造成水体富营养化,破坏了水体原有的生态平衡.
解答 解:(1)水分子为极性分子,分子的极性基(O端)应溶解于水(亲水基),链烃基(•端)不应溶解于水(憎水基),故答案为:C;水分子为极性分子,根据相似相溶原理,分子的极性基(O端)应溶解于水(亲水基),链烃基(•端)不应溶解于水(憎水基);
(2)A中极性基交替排列,可减少分子之间的斥力;D中极性基(O端)向外、链烃基(•端)向内的排列,在一定程度上使憎水基团脱离与水的接触,使体系能量最低,故答案为:AD; A中极性基交替排列,可减少分子之间的斥力;D中极性基(O端)向外、链烃基(•端)向内的排列,在一定程度上使憎水基团脱离与水的接触,使体系能量最低;
(3)烃基苯基是亲油基, 是亲油基,故答案为:
是亲油基,故答案为: ;
;
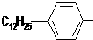
(4)十二烷基苯与硫酸反应生成对十二烷基苯磺酸,方程式: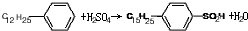 ,属于取代反应,故答案为:
,属于取代反应,故答案为: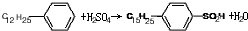 ;取代反应;
;取代反应;
(5)酶发挥催化作用需要适宜的条件(温度、酸碱度等),酶自身是蛋白质在不适宜的条件下容易变质(如高温),故答案为:酶发挥催化作用需要适宜的条件(温度、酸碱度等),酶自身是蛋白质在不适宜的条件(如高温、水解)下容易变质;
(6)三聚磷酸钠造成水体富营养化,破坏了水体原有的生态平衡,对人类的生存环境造成了很大的影响,故答案为:三聚磷酸钠造成水体富营养化,破坏了水体原有的生态平衡,对人类的生存环境造成了很大的影响.
点评 本题考查是对化学与技术的考查,涉及合成洗涤剂、油脂的性质、酶的性质、环境问题等,比较基础,理解合成洗涤剂中表面活性剂由亲油基团和亲水基团两部分构成,有利于基础知识的巩固.


科目:高中化学 来源: 题型:解答题
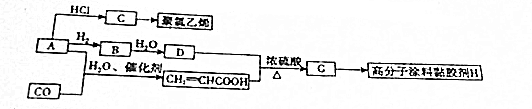
 ,A→C的反应类型:加成反应.
,A→C的反应类型:加成反应. ,写出D的同分异构体的结构简式:CH3OCH3.
,写出D的同分异构体的结构简式:CH3OCH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组在实验室用如下装置制备氯气.
某化学兴趣小组在实验室用如下装置制备氯气.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
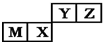
| A. | 原子半径:M>X>Y>Z | |
| B. | M的氯化物是弱电解质 | |
| C. | X的最简单气态氢化物的热稳定性比Z的小 | |
| D. | 简单离子的半径M小于Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
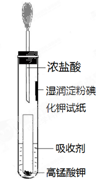 氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com