
| A. |  | B. | 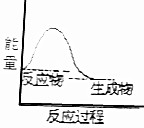 | ||
| C. | 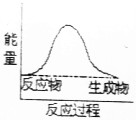 | D. | 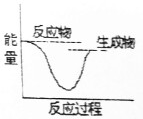 |
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液与碳酸反应 | B. | Cu(OH)2与稀硝酸反应 | ||
| C. | Ba(OH)2溶液与稀硫酸反应 | D. | KOH溶液与稀盐酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不能自发进行的氧化还原反应,通过电解的原理可以实现 | |
| B. | 电镀时保持电流恒定,升高温度不改变电解反应速率 | |
| C. | 电解精炼铜电解槽底部会形成含少量Ag、Fe、Pt等金属的阳极泥 | |
| D. | 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 | |
| E. | MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液,若电解电路中通过2mol电子,MnO2的理论产量为1mol | |
| F. | 燃料电池是将燃料燃烧所放出的能量转化为化学能的装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{4}{5}$mol•L-1 | B. | $\frac{1}{14}$mol•L-1 | C. | $\frac{1}{22.4}$mol•L-1 | D. | $\frac{1}{28}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2+X2═2HX | B. | X2+H20═HX+HXO | ||
| C. | NaX+AgNO3═AgX↓+NaNO3 | D. | 2NaX+H2SO4(浓)═Na2SO4+2HX |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2>Fe3+>Cu2+>PbO2 | B. | PbO2>Cl2>Fe3+>Cu2+ | ||
| C. | Fe3+>Cu2+>PbO2>Cl2 | D. | Cu2+>Fe3+>Cl2>PbO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
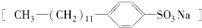 是常用洗涤剂的主要成分.其结构可用图形
是常用洗涤剂的主要成分.其结构可用图形 来表示,•端为链烃基,O端为极性基.根据这一结构特点,试分析和回答下列问题:
来表示,•端为链烃基,O端为极性基.根据这一结构特点,试分析和回答下列问题: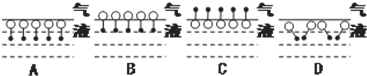
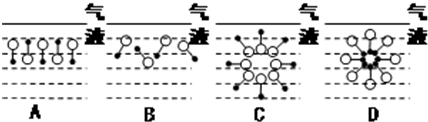
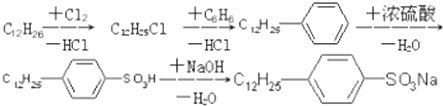
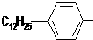 .
.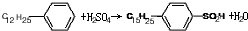 ,反应类型为取代反应.
,反应类型为取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
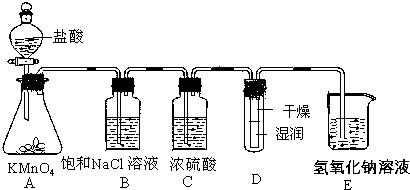
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com