
【题目】下列关于糖类的说法正确的是( )
A. 麦芽糖水解生成互为同分异构体的葡萄糖和果糖
B. 糖类都有甜味,具有CnH2mOm的通式
C. 淀粉和纤维素都属于多糖类天然高分子化合物
D. 用银镜反应可以判断淀粉水解是否完全
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验原理或实验操作正确的是

A.用装置甲收集SO2并验证其漂白性
B.用装置乙验证氯气与水反应有盐酸生成
C.用澄清石灰水鉴别苏打溶液和小苏打溶液
D.用NaOH溶液除去苯中混有的少量苯酚,反应后分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气在农业和国防工业都有很重要的作用,历史上诺贝尔化学奖曾经有3次颁给研究氮气与氢气合成氨气的化学家。
(1)下图表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答

①写出氮气和氢气合成氨的热化学方程式:_____________。
②对于合成氨的反应下列说法正确的是_____________(填编号)。
A.该反应在任意条件下都可以自发进行
B.加入催化剂,能使该反应的E和△H都减小
C.若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1>K2
D.该反应属于人工固氮
(2)现在普遍应用的工业合成氨的方法为N2+3H2![]() 2NH3,是哈伯于1905年发明的,但此法达到平衡时反应物的转化率不高。
2NH3,是哈伯于1905年发明的,但此法达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是_________________。
A.使用的更高效催化剂 B.升高温度
C.及时分离出氨气 D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2L的密闭容器中发生N2+3H2![]() 2NH3的反应,左下图表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)=_______________。从11min起,压缩容器的体积为1L,则n(N2)的变化曲线为_____________________。
2NH3的反应,左下图表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)=_______________。从11min起,压缩容器的体积为1L,则n(N2)的变化曲线为_____________________。
A. a B.b C.c D.d

(3)随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到500℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质里,用吸附在它内外表面上的金属钯多晶薄膜作电极,实现了常压、570℃条件下高转化率的电解法合成氮(装置如右上图)。则钯电极上的电极反应式是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向BaCl2溶液中通入SO2气体,没有产生沉淀,继续通入另一种气体,产生沉淀,则通入的气体不可能是( )
A. CO2 B. NO2
C. Cl2 D. NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁的化合物在化工生产和药物合成上有重要用途。某兴趣小组以一种工业废渣(主要成分为MgCO3、MgSiO3和少量Fe的氧化物)为原料制备MgCO3·3H2O。实验过程如下:
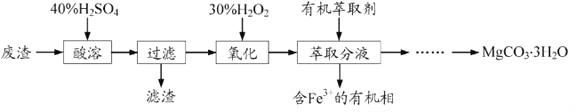
(1)废渣的成分为_________(填化学式),过滤装置在使用一段时间后需用NaOH溶液清洗,用化学方程式表示其清洗原理_____________________。
(2)加入H2O2的目的是__________________,一段时间后,溶液中有气泡出现并放热,则产生气泡的原因是____________。
(3)萃取分液中要用到分液漏斗,分液漏斗在使用前须洗干净并________________。萃取分液的目的是____________。(填序号)
A、除去水溶液中的铁离子
B、增加镁离子在水中的溶解性
C、富集铁元素,可以回收利用
(4)萃取后得到的水溶液制备MgCO3·3H2O的实验操作:边搅拌边向溶液中滴加Na2CO3溶液至有大量沉淀生成,静置,________,确定沉淀完全后,过滤、____________,得到MgCO3·3H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X和W同主族且W的单质是重要的半导体材料,Y原子的最外层电子数是其内层电子数的3倍,Z2+与Y2-核外电子排布相同。下列说法正确的是
A. X的氢化物中仅含有极性键
B. X与Y形成的三原子分子的电子式是![]()
C. 原子半径Z>Y,离子半径Z2+< Y2-
D. X、Y的非金属性强弱可用其氧化物的水化物的酸性强弱来推断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物C的分子式为C9H9OCl.C分子中有一个甲基且苯环上只有一条侧链;一定条件下C能发生银镜反应;C与其他物质之间的转化如图所示:
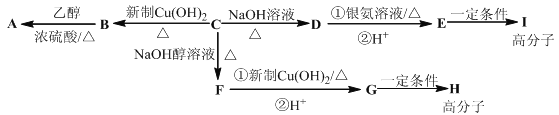
(1)F中含氧官能团的名称是 ,B→A的反应类型是 ;
(2)C的结构简式是 ,H的结构简式是 ;
(3)写出下列化学方程式:①D与银氨溶液反应 ;②E→I .
(4)D的一种同系物W(分子式为C8H8O2)有多种同分异构体,则符合以下条件W的同分异构体有 种,写出其中核磁共振氢谱有4个峰的结构简式 .
①属于芳香族化合物
②遇FeCl3溶液不变紫色
③能与NaOH溶液发生反应但不属于水解反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物用途广泛。某矿渣的土要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,如图是从该矿渣中回收NiSO4的工艺路线:

已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4,NiFe2O4在焙烧过程中
生成NiSO4、Fe2(SO4)3。锡(Sn)位子第五周期第IVA族.
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是________________。
(2)"浸泡“过程中Fe2(SO4)3生成FeO(OH)的离子方程式为__________,“浸渣”的成分除Fe2O3、FeO(OH)外还含有____________ (填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将 Fe3+还原为Fe2+ ,所需SnCl2的物质的量不少于Fe3+物质的量的_____倍;除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+ ,还原产物为Cr3+,滴定时反应的离子方程式________________。
⑷“浸出液”中c(Ca2+) =1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-)=______mol·L-1。[己知Ksp(CaF2) > 4.0×10-11]
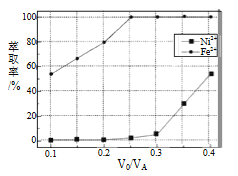
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值是__________。
(6)己知正十二烷可用作该工艺的萃取剂。用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷。己知电解总反应为:
2C6H13COONa + 2CH3OH![]() C12H26 + 2CO2↑+H2↑+2CH3ONa
C12H26 + 2CO2↑+H2↑+2CH3ONa
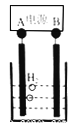
下列说法正确的是(_____)
A.图中电源的A极为直流电源的负极
B.加入金属钠可以将酸转化为钠盐,提高离子浓度,增强导电性
C.阳极电极反应为:2C6H13COO--2e- =C12H26+2CO2↑
D.反应一段时间后将电源正负极反接,会产生杂质影响正十二烷的制备
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com