
| A、c1=c2 |
| B、c1>c2 |
| C、c1≥c2 |
| D、c1<c2 |


科目:高中化学 来源: 题型:
| 编号 | 实验 | 操作 |
| A | 氨气的收集和检验 | 用向上排空气法收集氨气,并用干燥的红色石蕊试纸放在集气瓶口检验氨气是否收集满 |
| B | 配制一定浓度的氯化钾溶液1000mL | 准确称取氯化钾固体,放入到1000ml的容量瓶中,加水溶解,振荡摇匀,定容 |
| C | 制备Fe(OH)3胶体 | 将FeCl3固体小心加入沸水中 |
| D | 取出分液漏斗中所需的上层液体 | 从分液漏斗下端管口放出下层液体,关闭活塞,换一个接收容器,从分液漏斗上端口倒出所需液体 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②④ | C、①④ | D、只有② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH3、HCl的水溶液都能导电,但NH3不是电解质 |
| B、Na2O、Na2O2组成元素相同,与CO2反应产物也相同 |
| C、CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| D、新制氯水和SO2都具有漂白性,都能使紫色石蕊试液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
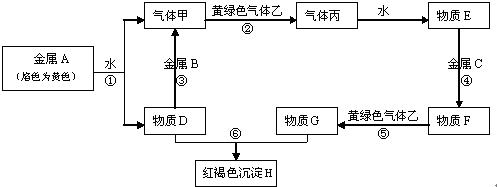
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能使甲基橙呈红色的溶液:Ba2+、Al3+、NO3-、Cl- |
| B、由水电离出的c(H+)=1×10-11 mol?L-1溶液:Na+、Mg2+、Cl-、NO3- |
| C、0.2 mol?L-1的NaNO3溶液:H+、Fe2+、SO42-、Cl- |
| D、与Fe反应生成H2的溶液:NH4+、K+、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol N2所含有的原子数为NA |
| B、标准状况下,22.4 L水中含有的水分子数为NA |
| C、标准状况下,22.4 L氯化氢所含的原子数为NA |
| D、32 g O2所含的氧原子数目为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com