
| n |
| v |
 AgOH+H+;抑制;
AgOH+H+;抑制;| 1.8×10-11 |
| 0.0012 |
| 2.0×10-20 |
| (10-3 )2 |


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
| A、C2H4和C2H2 |
| B、C2H4和C3H6 |
| C、C3H6和C2H2 |
| D、C3H6和C3H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、负极,被氧化 |
| B、负极,被还原 |
| C、正极,被氧化 |
| D、正极,被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
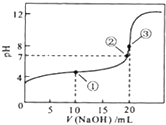 常温下,用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/LHCl溶液,滴定曲线如图所示,下列说法正确的是( )
常温下,用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/LHCl溶液,滴定曲线如图所示,下列说法正确的是( )| A、a=20.0 |
| B、滴定过程中,不可能存在:c(Cl-)>c(H)+>c(Na+)>c(OH-) |
| C、若用酚酞作指示剂,当滴定到溶液明显由无色变为红色时停止滴定 |
| D、若将盐酸换作同浓度的醋酸,则滴定到pH=7时,a>20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含5个碳原子的有机物,每个分子中最多可形成4个C-C单键 |
| B、油脂都不能使溴的四氯化碳溶液褪色 |
| C、可用新制的氢氧化铜悬浊液检验淀粉是否水解完全 |
| D、煤油可由石油分馏获得,可用作燃料和保存少量金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升髙温度,v正变大,v逆变小 |
| B、恒温恒容,充入O2,02的转化率升高 |
| C、恒温恒压,充人N2,平衡不移动 |
| D、恒温恒容,平衡前后混合气体的密度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c1=c2 |
| B、c1>c2 |
| C、c1≥c2 |
| D、c1<c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H2O+O2+4e-═4OH- |
| B、Fe-3e-═Fe3+ |
| C、Fe2++2OH-═Fe(OH)2 |
| D、4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com