
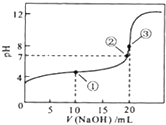
 常温下,用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/LHCl溶液,滴定曲线如图所示,下列说法正确的是( )
常温下,用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/LHCl溶液,滴定曲线如图所示,下列说法正确的是( )| A、a=20.0 |
| B、滴定过程中,不可能存在:c(Cl-)>c(H)+>c(Na+)>c(OH-) |
| C、若用酚酞作指示剂,当滴定到溶液明显由无色变为红色时停止滴定 |
| D、若将盐酸换作同浓度的醋酸,则滴定到pH=7时,a>20.00 |


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
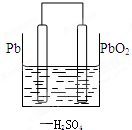 (1)铅蓄电池在生产生活中有广泛的应用,其工作原理为总方程式:Pb+PbO2+2H2SO4═2PbSO4+2H2O,其中负极为
(1)铅蓄电池在生产生活中有广泛的应用,其工作原理为总方程式:Pb+PbO2+2H2SO4═2PbSO4+2H2O,其中负极为查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验 | 操作 |
| A | 氨气的收集和检验 | 用向上排空气法收集氨气,并用干燥的红色石蕊试纸放在集气瓶口检验氨气是否收集满 |
| B | 配制一定浓度的氯化钾溶液1000mL | 准确称取氯化钾固体,放入到1000ml的容量瓶中,加水溶解,振荡摇匀,定容 |
| C | 制备Fe(OH)3胶体 | 将FeCl3固体小心加入沸水中 |
| D | 取出分液漏斗中所需的上层液体 | 从分液漏斗下端管口放出下层液体,关闭活塞,换一个接收容器,从分液漏斗上端口倒出所需液体 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入药品的顺序为Na2CO3、NaOH、BaCl2和盐酸 |
| B、第②步中结晶出的MgCl2?6H2O可在空气中受热分解制无水MgCl2 |
| C、在第③④⑤步中溴元素均被氧化 |
| D、由海水提取的金属镁能与金属铝、氢氧化钠溶液在一定条件下形成原电池,金属镁作该原电池正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)═c(Y-)+c(HY) |
| B、c(OH-)═c(H+)+c(HY) |
| C、c(Y-)>c(Na+)>c(OH-)>c(H+) |
| D、c(Na+)+c(H+)═c(OH-)+c(Y-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能使甲基橙呈红色的溶液:Ba2+、Al3+、NO3-、Cl- |
| B、由水电离出的c(H+)=1×10-11 mol?L-1溶液:Na+、Mg2+、Cl-、NO3- |
| C、0.2 mol?L-1的NaNO3溶液:H+、Fe2+、SO42-、Cl- |
| D、与Fe反应生成H2的溶液:NH4+、K+、SO42-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com