
| A、金刚石和C60 |
B、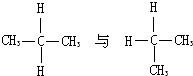 |
C、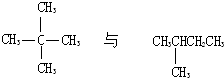 |
| D、CH4与CH3CH3 |
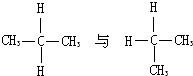 :丙烷不存在同分异构体,二者为同一种物质,故B错误;
:丙烷不存在同分异构体,二者为同一种物质,故B错误;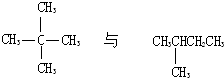 二者分别为新戊烷和异戊烷,都是戊烷的同分异构体,故C正确;
二者分别为新戊烷和异戊烷,都是戊烷的同分异构体,故C正确;

科目:高中化学 来源: 题型:
| A、a>b>c |
| B、c>a>b |
| C、a>c>b |
| D、b>a>c |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、负极,被氧化 |
| B、负极,被还原 |
| C、正极,被氧化 |
| D、正极,被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度/(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度/(mol/L) | c1 | c2 | 0.4 |
| A、10min内,v(Cl2)=0.04mol/(L?min) |
| B、当反应达到平衡时,容器中Cl2为1.2mol |
| C、升高温度,反应的平衡常数减小,则平衡时PCl3的转化率变大 |
| D、平衡后移走2.0mol PCl3和1.0mol Cl2,在相同条件下再达平衡时,c(PCl5)=0.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
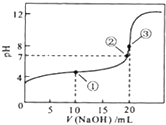 常温下,用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/LHCl溶液,滴定曲线如图所示,下列说法正确的是( )
常温下,用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/LHCl溶液,滴定曲线如图所示,下列说法正确的是( )| A、a=20.0 |
| B、滴定过程中,不可能存在:c(Cl-)>c(H)+>c(Na+)>c(OH-) |
| C、若用酚酞作指示剂,当滴定到溶液明显由无色变为红色时停止滴定 |
| D、若将盐酸换作同浓度的醋酸,则滴定到pH=7时,a>20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升髙温度,v正变大,v逆变小 |
| B、恒温恒容,充入O2,02的转化率升高 |
| C、恒温恒压,充人N2,平衡不移动 |
| D、恒温恒容,平衡前后混合气体的密度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com