
| A、含5个碳原子的有机物,每个分子中最多可形成4个C-C单键 |
| B、油脂都不能使溴的四氯化碳溶液褪色 |
| C、可用新制的氢氧化铜悬浊液检验淀粉是否水解完全 |
| D、煤油可由石油分馏获得,可用作燃料和保存少量金属钠 |


科目:高中化学 来源: 题型:
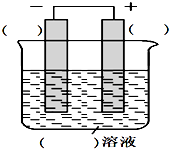 下列是构成原电池的实验方案,请按要求回答下列问题:
下列是构成原电池的实验方案,请按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

| A、第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入药品的顺序为Na2CO3、NaOH、BaCl2和盐酸 |
| B、第②步中结晶出的MgCl2?6H2O可在空气中受热分解制无水MgCl2 |
| C、在第③④⑤步中溴元素均被氧化 |
| D、由海水提取的金属镁能与金属铝、氢氧化钠溶液在一定条件下形成原电池,金属镁作该原电池正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)═c(Y-)+c(HY) |
| B、c(OH-)═c(H+)+c(HY) |
| C、c(Y-)>c(Na+)>c(OH-)>c(H+) |
| D、c(Na+)+c(H+)═c(OH-)+c(Y-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升温增压 | B、降温减压 |
| C、升温减压 | D、降温增压 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH3、HCl的水溶液都能导电,但NH3不是电解质 |
| B、Na2O、Na2O2组成元素相同,与CO2反应产物也相同 |
| C、CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| D、新制氯水和SO2都具有漂白性,都能使紫色石蕊试液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温下,1mol SO3含有的分子数为NA个 |
| B、0.1molAl3+离子含有核外电子数为NA个 |
| C、1molCl2与1mol Fe反应,转移电子为3 NA个 |
| D、标准状况下2.24L己烷含有分子数目为0.1 NA个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com