
【题目】(Ⅰ)已知氯水有漂白性,是因为含有 (化学式),能与AgNO3反应生成 色沉淀,是因为含有 (名称)离子;
(Ⅱ)在下图所示的物质转化关系中,A是常见的气态氢化物,其水溶液呈碱性,B是能使带火星的木条复燃的无色无味气体, G是一种红色金属单质。(部分反应中生成物没有全部列出,反应条件未列出)
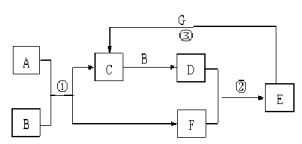
请回答下列问题:
(1)实验室制取A的化学方程式
(2)反应①的化学方程式为 。当有1molA参加反应时,转移 mol电子。
(3)反应②的化学方程式为 。
(4)反应③的离子方程式为
【答案】(Ⅰ)HClO;白;氯
(Ⅱ)(1)2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(2)4NH3 + 5O2![]() 4NO + 6H2O;5
4NO + 6H2O;5
(3)3NO2+H2O=2HNO3+NO
(4)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
【解析】
试题分析:(Ⅰ)已知氯水中存在化学反应:Cl2+H2OH++Cl-+HClO,其中HClO具有强氧化性,能将有色物质氧化成无色物质,因而有漂白性;氯离子(Cl-)能与AgNO3反应生成白色AgCl沉淀。
故答案为:HClO;白;氯;
(Ⅱ)B能使带火星的木条复燃的无色无味气体,则B是氧气;G是一种红色金属单质,则G是铜;A是常见的气态氢化物,其水溶液呈碱性,则A为NH3;NH3能与氧气反应生成C与F,C能与氧气反应生成D,则C为NO、F是水、D为NO2;D与水反应得到E,E能与Cu反应得到C,则E为2HNO3。
(1)由上述分析可知,A为NH3,实验室制取氨气的化学方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。
故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(2)由上述分析可知,反应①的化学方程式为4NH3 + 5O2![]() 4NO + 6H2O;由方程式可知,当有当
4NO + 6H2O;由方程式可知,当有当
有4mol氨气参加反应时,转移20mol电子,则当有1mol氨气参加反应时,转移5mol电子。
故答案为:4NH3 + 5O2![]() 4NO + 6H2O;5;
4NO + 6H2O;5;
(3)反应②为二氧化氮与水反应生成硝酸和NO,该反应的化学方程式为:3NO2+H2O=2HNO3+NO。
故答案为:3NO2+H2O=2HNO3+NO;
(4)反应③为铜和稀硝酸的反应,该反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. SO2的漂白原理与次氯酸相同
B. 煤的干馏可得到石油气、汽油、煤油、柴油等
C. 从海水中提取所有物质都必须通过化学反应才能实现
D. 纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如下表。甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素。下列判断正确的是( )
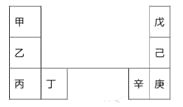
A. 金属性:甲>乙>丁
B. 原子半径:辛>己>戊
C. 丙和庚的原子核外电子数相差12
D. 乙的单质在空气中燃烧生成只含离子键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将15.6gNa2O2和5.4gAl同时放入一定量的水中,充分反应后得到200mL澄清溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则
A.反应过程中得到6.72L的气体(标准状况下)
B.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
C.最终得到7.8g的沉淀
D.最终得到的溶液中c(NaCl)=1.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废催化剂含58.2%的SiO2、21.0%的ZnO、4.50%的ZnS和12.8%的CuS及少量的Fe3O4。某同学用15.0 g该废催化剂为原料,回收锌和铜。采用的实验方案如下:
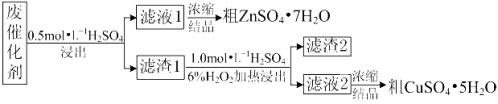
已知:① ZnS与稀硫酸反应时,化合价不变;
② CuS既不溶解于稀硫酸,也不与稀硫酸反应。
回答下列问题:
(1)在下列装置中,第一次浸出必须用________________,第二次浸出应选用______________。(填标号)。第二次浸出时,加热温度不宜过高的原因是 。

(2)滤液1中含有Fe2+,请根据提供的试剂进行检验,则检验方法为: 。
(提供的试剂:稀盐酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水)
(3)将滤液1、滤液2蒸发浓缩至 时,停止加热,然后冷却结晶得到相应的粗产品。
(4)若滤渣2中含有淡黄色固体,写出第二次浸出的化学反应方程式: 。
(5)某同学在实验完成之后,得到1.50 g CuSO4·5H2O,则铜的回收率为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10mL 浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成的是
A. K2SO4 B. H2SO4 C. CuSO4 D. Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关问题,与盐的水解有关的是
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂 ②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂 ③草木灰与铵态氮肥不能混合施用 ④实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞 ⑤加热蒸干AlCl3溶液得到Al(OH)3固体
A. ①②③ B. ②③④ C. ①④⑤ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液只含下表离子中的几种,且各离子的物质的量浓度相等(不考虑水的电离与离子水解)。
阳离子 | K+、NH4+、Fe2+、Mg2+、Cu2+ |
阴离子 | OH-、Cl-、CO32-、SO42- |
某同学进行了如下实验(必要时可加热):

下列说法正确的是
A. 由沉淀A推断原溶液中一定含有SO42-
B. 原溶液中只含有NH4+、Fe2+、Cl-、SO42-
C. 滤液A中可能含有K+
D. 沉淀B中一定含有Mg(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com