
【题目】下列叙述中,正确的是( )
A. 12g碳所含的原子数就是阿伏加德罗常数
B. 1molHCl的质量是36.5 g·mol-1
C. Cl2的摩尔质量等于它的相对分子质量
D. 摩尔是表示物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】I.(1)已知食盐常加入KIO3来补充碘元素,检验食盐中是否加碘,可利用如下反应:__KIO3+___KI+___H2SO4═___K2SO4+___I2+___H2O(配平反应方程式)
①利用上述反应检验食盐中是否加碘,所需试剂是________(填下列选项的序号)
A、碘水B、KI溶液C、淀粉溶液D、稀硫酸E、AgNO3溶液
②如果反应中转移0.2mol电子,则生成I2的物质的量为___________
(2)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染.化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气)若反应中消耗Cl21.5mol则被氧化的NH3在标准状况下的体积为__________L.
II.用98%的浓硫酸(其密度为1.84g/cm3)配制100mL1.0mol.L-1稀硫酸,
实验步骤如下:①计算所用浓硫酸的体积②量取一定体积的浓硫酸③溶解④检漏、转移、洗涤⑤定容、摇匀。若实验仪器有:A.100mL量筒 B.托盘天平C.玻璃棒D.50mL容量瓶 E.10mL量筒F.胶头滴管G.50mL烧杯H.100mL容量瓶
回答下列问题:
(1)需量取浓硫酸的体积为___________mL.
(2)实验时选用的仪器有___________(填序号)
(3)配制过程中,下列情况会使配制结果偏高的是___________(填序号)
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
④所用的浓硫酸长时间放置在密封不好的容器中⑤用量筒量取浓硫酸时仰视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子表所用的纽扣电池,两极材料为锌和氧化银,电解质溶液为KOH溶液,电池反应为 Ag2O + Zn + H2O═2Ag + Zn(OH)2,示意图如右。下列判断正确的是( )

A. 锌为负极,被还原
B. 纽扣电池工作时,OHˉ移向Ag2O
C. 每6.5 g 锌发生反应时,转移电子0.1 NA
D. 纽扣电池工作时,电解质溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示。将甲醛水溶液与氨水混合蒸发可制得乌洛托品。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为( )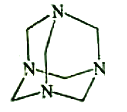
A. 1:1 B. 2:3 C. 3:2 D. 2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的( )
A. 酸性氧化物和碱性氧化物都是电解质
B. 将NaOH溶液,逐滴加入FeCl3溶液,可制备氢氧化铁胶体
C. 硫酸、氢氧化钠、氯化钠均为强电解质,都属于离子化合物
D. 离子键一定只存在于离子化合物中,共价键不一定只存在于共价化合物中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【天津市和平区2017届第三次质量调查(三模)】A、B、C、D、E、F是分属三个短周期的主族元素,且原子序数依次增大。A、D同主族,B的氢化物水溶液呈碱性,C、E同主族,形成的化合物EC2是形成酸雨的主要物质之一。请化学用语回答下列问题:
(1)F在元素周期表中的位置为_______________。
(2)常温下,液态的B2A4与气态的BC2两者发生反应生成无毒物质,16g B2A4发生反应放热akJ,该反应的热化学方程式为_______________。
(3)D2E溶液在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。H的电子式为_______,写出在空气中长期放置生成H的化学反应方程式为:_________。H的溶液与稀硫酸反应产生的现象为_____________。
(4)化学家发现一种化学式为A4B4的离子化合物,一定条件下1mol A4B4熔融电离生成两种离子各1mol,则该物质熔融时的电离方程式为____________。
(5)向30mL某浓度由A、B、C、D中三种元素形成一元强碱溶液通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V[HCl(aq)]的关系有下列图示两种情况(不计CO2的溶解)。
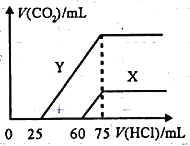
则曲线Y表明M中的溶质为________;原NaOH溶液的物质的量浓度为_______;由曲线X、Y可知,两次实验通入的CO2的体积比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【华南师大附中2017届三模】CO2和甲烷催化合成CO和H2是CO2资源化利用的有效途径。主要反应为
Ⅰ:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) △H=+247kJ/mol
2CO(g)+2H2(g) △H=+247kJ/mol
(1)已知CH4(g)+H2O(g) ![]() CO(g)+H2(g) △H=+206kJ/mol
CO(g)+H2(g) △H=+206kJ/mol
写出CH4和水蒸气反应生成CO2的热化学方程式_________。
(2)在恒温、恒容的密闭容器中发生反应I,下列选项能够说明反应I达到平衡状态的是______。
A.混合气体的密度不变
B.混合气体的总压强不变
C.CH4、CO2、CO、H2的物质的量之比为1:1:2:2
D.3V正(H2)=V逆(CH4)
E.混合气体的平均相对分子质量不变
(3)催化合成的温度通常维持在550-750℃之间,从反应速率角度分析其主要原因可能是_________。
(4)将CH4与CO2各1mol充入某密闭容器中,发生反应I。100Kpa时,反应I到达平衡时CO2的体积分数与温度的关系曲线如图所示。

①图中A、B、C三点表示不同温度、压强下达到平衡时CO2的体积分数,则______点对应的平衡常数最小,判断依据是________;__________点对应的压强最大。
②300℃,100Kpa下,该容器中反应I经过40min达到平衡,计算反应在0-40min内的平均反应速率为v(CO2)=_________mol/min(结果保留两位有效数字),该温度下的压强平衡常数Kp=________。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【六安市第一中学2017届6月适应性考试】下列关于有机化合物的说法正确的是
A.—个苯环上已经连有-CH3、-CH2CH3、-OH三种基团,如果在苯环上再连接一个-CH3,其同分异构体有16种
B.裂化汽油可用于萃取溴水中的溴
C.除去乙醇中的少量水,方法是加入新制生石灰,经过滤后即得乙醇
D.除去乙酸乙酯中的乙酸和乙醇杂质,可加入足量烧碱溶液,通过分液即得乙酸乙酯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com