
【题目】【华南师大附中2017届三模】CO2和甲烷催化合成CO和H2是CO2资源化利用的有效途径。主要反应为
Ⅰ:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) △H=+247kJ/mol
2CO(g)+2H2(g) △H=+247kJ/mol
(1)已知CH4(g)+H2O(g) ![]() CO(g)+H2(g) △H=+206kJ/mol
CO(g)+H2(g) △H=+206kJ/mol
写出CH4和水蒸气反应生成CO2的热化学方程式_________。
(2)在恒温、恒容的密闭容器中发生反应I,下列选项能够说明反应I达到平衡状态的是______。
A.混合气体的密度不变
B.混合气体的总压强不变
C.CH4、CO2、CO、H2的物质的量之比为1:1:2:2
D.3V正(H2)=V逆(CH4)
E.混合气体的平均相对分子质量不变
(3)催化合成的温度通常维持在550-750℃之间,从反应速率角度分析其主要原因可能是_________。
(4)将CH4与CO2各1mol充入某密闭容器中,发生反应I。100Kpa时,反应I到达平衡时CO2的体积分数与温度的关系曲线如图所示。

①图中A、B、C三点表示不同温度、压强下达到平衡时CO2的体积分数,则______点对应的平衡常数最小,判断依据是________;__________点对应的压强最大。
②300℃,100Kpa下,该容器中反应I经过40min达到平衡,计算反应在0-40min内的平均反应速率为v(CO2)=_________mol/min(结果保留两位有效数字),该温度下的压强平衡常数Kp=________。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
【答案】 CH4(g)+2H2O(g) ![]() CO2(g)+4H2(g) ΔH=+165KJ/mol BE 在该温度范围内,催化剂的活性较大,反应速率快(合理即给分) A 反应I吸热反应,温度降低,平衡常数减小 C 2.8×10-3 6.25KPa2
CO2(g)+4H2(g) ΔH=+165KJ/mol BE 在该温度范围内,催化剂的活性较大,反应速率快(合理即给分) A 反应I吸热反应,温度降低,平衡常数减小 C 2.8×10-3 6.25KPa2
【解析】(1)已知:①CH4(g)+H2O(g) ![]() CO(g)+H2(g) △H=+206kJ/mol
CO(g)+H2(g) △H=+206kJ/mol
②CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) △H=+247kJ/mol
2CO(g)+2H2(g) △H=+247kJ/mol
根据盖斯定律可知①×2-②即得到CH4和水蒸气反应生成CO2的热化学方程式为CH4(g)+2H2O(g) ![]() CO2(g)+4H2(g) ΔH=+165KJ/mol。(2)A. 密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此混合气体的密度不变不能说明,A错误;B.正反应体积增大,则混合气体的总压强不变说明反应达到平衡状态,B正确;C.CH4、CO2、CO、H2的物质的量之比为1:1:2:2不能说明正逆反应速率相等,则不一定处于平衡状态,C错误;D.3V正(H2)=V逆(CH4)不能满足反应速率之比是化学计量数之比,没有达到平衡状态,D错误;E. 混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以混合气体的平均相对分子质量不变说明反应达到平衡状态,E正确;答案选BE;(3)催化剂的活性受温度影响较大,因此主要原因可能是在该温度范围内,催化剂的活性较大,反应速率快。(4)①由于反应I吸热反应,温度降低,平衡常数减小,所以A点对应的平衡常数最小;C点温度最高,反应物转化率最大,由于正反应体积增大,则C点对应的压强最大。②根据方程式可知:
CO2(g)+4H2(g) ΔH=+165KJ/mol。(2)A. 密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此混合气体的密度不变不能说明,A错误;B.正反应体积增大,则混合气体的总压强不变说明反应达到平衡状态,B正确;C.CH4、CO2、CO、H2的物质的量之比为1:1:2:2不能说明正逆反应速率相等,则不一定处于平衡状态,C错误;D.3V正(H2)=V逆(CH4)不能满足反应速率之比是化学计量数之比,没有达到平衡状态,D错误;E. 混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以混合气体的平均相对分子质量不变说明反应达到平衡状态,E正确;答案选BE;(3)催化剂的活性受温度影响较大,因此主要原因可能是在该温度范围内,催化剂的活性较大,反应速率快。(4)①由于反应I吸热反应,温度降低,平衡常数减小,所以A点对应的平衡常数最小;C点温度最高,反应物转化率最大,由于正反应体积增大,则C点对应的压强最大。②根据方程式可知:
CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
起始量(mol)1 1 0 0
转化量(mol)x x 2x 2x
平衡量(mol)1-x 1-x 2x 2x
300℃,100Kpa下平衡时CO2体积分数是0.4,则![]() ,解得x=1/9,则在0-40min内的平均反应速率为v(CO2)=1/(9×40)=2.8×10-3mol/min,该温度下的压强平衡常数Kp=
,解得x=1/9,则在0-40min内的平均反应速率为v(CO2)=1/(9×40)=2.8×10-3mol/min,该温度下的压强平衡常数Kp=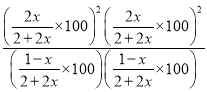 =6.25KPa2。
=6.25KPa2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】可逆反应达到平衡时,下列物理量发生变化,平衡一定发生移动的是( )
A. 反应物的浓度 B. 反应物的转化率
C. 正、逆反应速率 D. 体系的压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是( )
A. 12g碳所含的原子数就是阿伏加德罗常数
B. 1molHCl的质量是36.5 g·mol-1
C. Cl2的摩尔质量等于它的相对分子质量
D. 摩尔是表示物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯醇(CH2=CH-CH2OH)可发生的化学反应有( )
①氧化反应
②加成反应③置换反应
④加聚反应
⑤取代反应
A.①②③
B.①③④
C.②④⑤
D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2与ICl的反应分①、②两步进行,其能量曲线如下图所示,下列有关说法不正确的是( )

A. 反应②比①要容易发生是因为反应②活化能大
B. 反应①和②均为放热反应
C. H2(g)+2ICl(g)= I2(g)+2HCl(g) H= -218 kJ·molˉ1
D. 反应①和②均为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学反应方程式:
(1)实验室制取乙炔_______________________;
(2)由甲苯制备TNT_______________________;
(3)实验室使用溴检验苯酚_________________;
(4)甲醛与银氨溶液的反应_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验某溶液X中是否含有 Na+、K+、Fe3+、Mg2+、Iˉ、Cl-、CO32ˉ、SO42ˉ,限用的试剂有:盐酸、硫酸、硝酸银溶液、硝酸钡溶液。设计如下实验步骤,并记录相关现象。下列叙述不正确的是 ( )

A. 溶液X中一定含有Iˉ、CO32ˉ、SO42ˉ
B. 通过在黄色溶液中加入硝酸银溶液可以检验溶液X中是否存在Cl-
C. 试剂①为硝酸钡溶液
D. 通过焰色反应,可确认溶液X中阳离子的种类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是
A. 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I2+6OH-
B. 向NH4HSO3溶液中加过量的NaOH溶液并加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
C. 将过量SO2通入冷氨水中:SO2+NH3·H2O=HSO3-+NH4+
D. Ba(OH)2溶液中逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的OH-恰好反应一半时:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及硼的化合物有着广泛的用途。请回答下列问题:
(1)硼在元素周期表中的位置为_________,电子排布式是________,硼元素有两种天然同位素10B和11B,硼元素的近似相对原子质量为10.8,则两种同位素原子的原子个数之比为_______。
(2)单质硼(B)在一定条件下与NaOH溶液反应生成NaBO2和一种气体,请写出该反应的化学方程式________________。
(3)硼酸(H3BO3)是一种白色片状晶体,微溶于水,对人体的受伤组织有着和缓的防腐消毒作用。硼酸是一元弱酸,室温时0.1mol/L硼酸的pH为5,计算硼酸的电离常数K=__________。氟硼酸(HBF4)是一种强酸,仅以离子状态存在于水中,请写出BF4﹣的电子式__________。
(4)B2H6是硼的一种气态氢化物,因组成与乙烷(C2H6)相似而被称为乙硼烷。
①经测定B2H6中B原子最外层也满足8电子结构,由此推测B2H6与C2H6分子结构_________(填“相同”或“不相同”)。
②B2H6可由BF3与NaBH4在一定条件下反应制得,写出该反应的化学方程式_________。
③B2H6是强还原剂,它与水反应生成H3BO3和H2。若有0.1mol B2H6与水完全反应,则产生H2在标准状况下的体积为_________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com