
【题目】一种从海带中提取碘的实验流程如图:
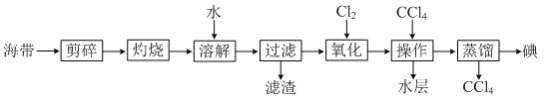
(1)“溶解”时需不断搅拌,目的是_____。
(2)“氧化”反应的离子方程式为_____。
(3)“操作”的名称是_____。
(4)蒸馏装置中连接自来水的仪器名称是_____。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如图所示(反应条件及其他物质已经略去):
![]()
(1)若A是一种金属,C是淡黄色固体,写出C的一种用途____;
(2)若常温下A为淡黄色固体单质,D为强酸,则B为___,D的浓溶液能使胆矾晶体由蓝变白,体现了D的___性。
(3)若A是化合物,C是红棕色气体,则
①A的电子式为___,实验室制备A气体的化学方程式为___。
②实验室检验A气体的方法为___。
③C转化为D的过程中,氧化剂与还原剂的质量比为___。
④将盛满B气体的试管倒扣在水槽中,并通入一定量O2,最终气体全部被吸收,所得溶液充满整个试管。若不考虑溶液扩散,计算所得溶液物质的量浓度为___mol·L-1。(标况下计算,保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E 五种物质中均含有同一种短周期主族元素R, 它们能发生如图所示的转化关系,已知A、B、D、E四种物质均难溶于水,单质R能与NaOH溶液反应生成盐和氢气。

下列说法正确的是( )
A. 反应①中氧化剂与还原剂的物质的量之比为1∶1
B. 化合物A既能溶于NaOH又能溶于氢氟酸
C. 反应④的离子方程式为:2R+2OH-+2H2O=2RO2-+3H2↑
D. 化合物C的溶液与反应①产生的气体能够发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国拥有自主知识产权的硅衬底高光效氮化镓发光二极管(简称LED)技术,已广泛用于照明,显像等多个领域。氮化镓的原子结构示意图及镓在元素周期表中的信息如图所示,下列说法不正确的是( )

A.氮元素位于元素周期表的第二周期
B.镓原子与镓离子相对原子质量几乎相等
C.镓的相对原子质量为69.72
D.一个Ga3+有34个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置来测定空气中氧气的含量,硬质玻璃管的体积为20mL,玻璃管两端分别连接带有刻度和注射器的瘪气球,对该实验认识错误的是( )
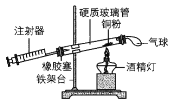
A.气球的作用是调节气压,而且使铜粉充分消耗氧气
B.该实验可以证明空气是混合物
C.在正常操作的情况下,反应结束后消耗氧气的总体积约为注射器中空气体积的五分之一
D.如果停止加热后没有冷却到室温就读数,则测定的氧气体积分数小于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①H+(aq)+OH-(aq)===H2O(l) ΔH1=-57.3 kJ·mol-1,
②H2(g)+![]() O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1,下列有关说法正确的是( )
O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1,下列有关说法正确的是( )
A. 向含0.1molNaOH的溶液中加入一定体积的0.1mol·L-1乙二酸,反应中的能量变化如图所示
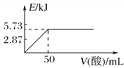
B. H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+2H2O(l) ΔH=-114.6 kJ·mol-1
C. 氢气的标准燃烧热为241.8 kJ·mol-1
D. 若反应②中水为液态,则同样条件下的反应热:ΔH>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:
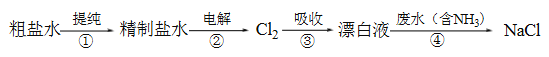
下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法正确的是( )
A. 2.3 g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA
B. 100g9.8%的硫酸与磷酸的混合液中含有氧原子数为0.4NA
C. 惰性电极电解食盐水,若线路中通过1NA电子电量,则阳极产生气体11.2L
D. 0.1 mol的CaC2中含阴离子数是0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甘氨酸合铜(II)是最早被发现的电中性内配盐,它的结构如图:
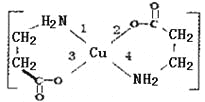
(1)基态Cu2+的最外层电子排布式为__。
(2)二甘氨酸合铜(II)中,第一电离能最大的元素与电负性最小的非金属元素可形成多种微粒,其中一种是5核10电子的微粒,该微粒的空间构型是__。
(3)lmol二甘氨酸合铜(II)含有的π键数目是__。
(4)二甘氨酸合铜(II)结构中,与铜形成的化学键中一定属于配位键的是__(填写编号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com