
 某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液.为点燃上述三个反应生成的H2,他们设计了如图所示的装置图:
某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液.为点燃上述三个反应生成的H2,他们设计了如图所示的装置图:| m |
| M |
| n |
| V |
| 2,3g |
| 23g/mol |
| 0.1mol |
| 0.02L |


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
 某实验小组对中学课本中已经学过的生成氢气的反应进行了研究,写出了如下三个可生成氢气的反应:
某实验小组对中学课本中已经学过的生成氢气的反应进行了研究,写出了如下三个可生成氢气的反应:查看答案和解析>>
科目:高中化学 来源: 题型:
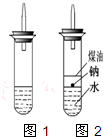
某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液。为点燃上述三个反应生成的H2,他们设计了如右图所示的装置图:
![]()
]请回答下列问题:
(1)写出Al和NaOH溶液反应的离子方程式_______________________________。
(2)在点燃H2之前必须先进行____________________________________________。
(3)实验小组在点燃用上述装置制得的H2时,①③实验获得成功,②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量又太少。于是他们准备增加钠的用量,可教师说太危险,你认为产生危险的原因是___________________________。
(4)实验小组查阅钠、苯(一种不溶于水的液态有机物)、水的密度分别为0.97 g·mL-1、0.88 g·mL-1、1.00 g·mL-1,并据此对实验进行了改进。在改进后的实验中H2的生成速率______________________。(填“减慢”或“加快”)
(5)2.3 g钠投入20 mL水中完全反应放出的气体在标准状况下的体积是_____________,所得溶液的物质的量浓度是______________________。(不计溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
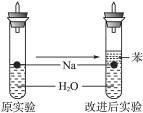
某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸 ②Na+水 ③Al+NaOH溶液。为点燃上述三个反应生成的H2,他们设计了如下装置(图1),请回答下列问题:
(1)写出Na与H2O反应的化学方程式_____________________________________。
(2)在点燃H2前必须先进行_____________________________________________,
方法是 _______________________________________________________。
 (3)实验小组在点燃用图1装置制得的H2时,①③实验获得成功,②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量太少。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是________________________________________________________________________。
(3)实验小组在点燃用图1装置制得的H2时,①③实验获得成功,②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量太少。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是________________________________________________________________________。
(4)实验小组查阅钠、苯、水的密度分别为0.97 g·mL-1、0.88 g·mL-1、1.00 g·mL-1,并据此对实验进行了改进(如图2),在改进后的实验中H2的生成速率减慢。原因是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山西省高考一轮复习阶段考试化学试卷(解析版) 题型:实验题
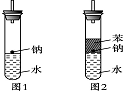
某实验小组对中学课本中可生成氢气的反应进行了研究,总结出四个可以生成H2的反应:①Zn+盐酸 ②Na+水 ③Al+NaOH溶液 ④Na+无水乙醇。为点燃上述四个反应生成的H2,他们设计了如下装置图:
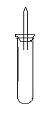
请回答下列问题:
⑴写出Na与H2O反应的化学方程式 ;
⑵在点燃H2之前必须先进行 ,方法是
;
⑶实验小组在点燃用上述装置制得的H2时,①③④实验获得成功,②却
失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的
用量太少。于是他们准备增加钠的用量,可老师说太危险,你认为产生危
险的原因是 。
⑷实验小组查阅钠、苯、水的密度分别为0.97g/mL、0.88g/mL、1.00g/mL,并据此对实验进行了改进。
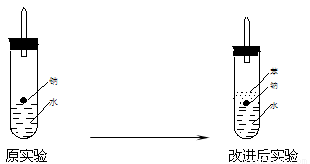
在改进后的实验中H2的生成速率减慢。原因是
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com