
 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。

 H2SO4+6NO2↑+2H2O。
H2SO4+6NO2↑+2H2O。 2Fe+Al2O3
2Fe+Al2O3
 H2SO4+6NO2↑+2H2O
H2SO4+6NO2↑+2H2O 2Fe+Al2O3
2Fe+Al2O3 。
。

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题

| A.X和R在同一周期 |
| B.原子半径:W>R>X |
| C.气态氢化物的稳定性:Y>X |
| D.X、Z形成的化合物中可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.M<N<Y<X<Z | B.N<M<Y<X<Z |
| C.N<M<X<Y<Z | D.X<Z<N<M<Y |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.M元素存在同素异形体 |
| B.M元素为非金属元素 |
| C.M的最高价氧化物对应的水化物都是强酸 |
| D.常温下,能稳定存在的M的氧化物都是酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Si(s)+2CO(g)
Si(s)+2CO(g) SiCl4(g)
SiCl4(g)  SiHCl3(l)+H2(g) + Q(Q>0)
SiHCl3(l)+H2(g) + Q(Q>0) Si(纯)+3HCl(g)
Si(纯)+3HCl(g)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 有关信息 |
| X | 最外层电子数是次外层的2倍 |
| Y | 元素的主要化合价为-2价 |
| Z | 其单质及化合物的焰色为黄色 |
| M | 与X同主族,其单质为半导体材料 |
| N | 其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 |
 2NY3(g)。温度分别为T1和T2时,NY3的体积分数随时间变化如下图。该反应的△H 0(填“>”、“<”或“=”,下同);若T1、T2时该反应的化学平衡常数分别为K1、K2,则K1 K2。
2NY3(g)。温度分别为T1和T2时,NY3的体积分数随时间变化如下图。该反应的△H 0(填“>”、“<”或“=”,下同);若T1、T2时该反应的化学平衡常数分别为K1、K2,则K1 K2。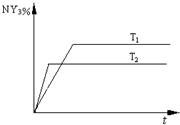
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com