
| 元素 | 有关信息 |
| X | 最外层电子数是次外层的2倍 |
| Y | 元素的主要化合价为-2价 |
| Z | 其单质及化合物的焰色为黄色 |
| M | 与X同主族,其单质为半导体材料 |
| N | 其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 |
 2NY3(g)。温度分别为T1和T2时,NY3的体积分数随时间变化如下图。该反应的△H 0(填“>”、“<”或“=”,下同);若T1、T2时该反应的化学平衡常数分别为K1、K2,则K1 K2。
2NY3(g)。温度分别为T1和T2时,NY3的体积分数随时间变化如下图。该反应的△H 0(填“>”、“<”或“=”,下同);若T1、T2时该反应的化学平衡常数分别为K1、K2,则K1 K2。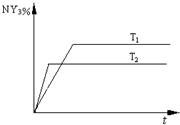
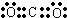 (1分);离子键和非极性共价键(1分);2Na2O2+2CO2=2Na2CO3+O2(2分)
(1分);离子键和非极性共价键(1分);2Na2O2+2CO2=2Na2CO3+O2(2分)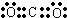 ;过氧化钠的电子式
;过氧化钠的电子式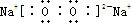 ,含有离子键和非极性共价键;过氧化钠能与二氧化碳反应生成碳酸钠和氧气,方程式为:2Na2O2+2CO2=2Na2CO3+O2
,含有离子键和非极性共价键;过氧化钠能与二氧化碳反应生成碳酸钠和氧气,方程式为:2Na2O2+2CO2=2Na2CO3+O2

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题

| A.M元素一定为金属元素 |
| B.X元素的最简单气态氢化物的热稳定性比Z元素的大 |
| C.若Y元素存在最高价含氧酸,其酸性比X元素的最高价含氧酸弱 |
| D.Z元素与氢元素一定能形成原子个数比为1︰1的共价化合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.Z元素的原子半径可能比Y元素的小 |
| B.Z的原子序数不可能是X的原子序数的2倍 |
| C.W的气态氢化物的稳定性一定比Y的强 |
| D.Z的最高价氧化物的水化物的酸性一定比W的强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.230Th的中子数比核外电子数多140 |
| B.230Th和232Th的化学性质相同 |
| C.232Th 转换成233U是化学变化 |
| D.Th 元素的相对原子质量是231 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.熔点:MgBr2<SiCl4<BN |
| B.冰和干冰均为分子晶体,冰的沸点、密度都高于干冰 |
| C.第ⅤA族元素的几种气态氢化物中,NH3是稳定性最高的氢化物 |
| D.同周期ⅦA族元素的氧化物对应水化物的酸性一定强于ⅥA族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com