
【题目】医疗上用作X射线透视肠胃的内服药“钡餐”的物质是
A.BaCO3B.BaOC.BaCl2D.BaSO4
科目:高中化学 来源: 题型:
【题目】对于反应A+3B=2C+2D来说,以下表示中,反应速率最快的是 ( )
A.v(A)=0.8 mol/ (L·s)B.v(B)=0.4 mol/ (L·s)
C.v(C)=0.6 mol/ (L·s)D.v(D)=1.8 mol/ (L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”,实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案,其中t3 <t2 <t1:
实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 (℃) | 溶液颜色褪至无色所需时间(s) | ||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | |||
① | 0.10 | 2.0 | 0.01 | 4.0 | 25 | t1 |
② | 0.20 | 2.0 | 0.01 | 4.0 | 25 | t2 |
③ | 0.20 | 2.0 | 0.01 | 4.0 | 50 | t3 |
请回答:
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,每消耗1molH2C2O4转移_______mol电子。当观察到紫色刚好褪去,参加反应的H2C2O4和KMnO4的物质的量之比为n(H2C2O4)∶n(KMnO4)=_________。
(2)实验①测得KMnO4溶液的褪色时间为t1=40s,忽略混合前后溶液体积的变化,这段时间内平均反应速率υ(KMnO4)=___________mol/(L·min)。
(3)根据表中的实验②和实验③数据,可以得到的结论是__________________________。
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图a所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应当如图b所示:

该小组同学根据图b所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设是__________________________________________。
②请你帮助该小组同学完成实验方案,并填写表中空白.
实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 (℃) | 向试管中加入少量固体 | 溶液颜色褪至无色所需时间(s) | ||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | ||||
④ | 0.20 | 2.0 | 0.01 | 4.0 | 50 | _____ | t4 |
③若该小组同学提出的假设成立,应观察到的现象是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电化学气敏传感器的工作原理如图所示,下列说法不正确的是

A. a极为负极
B. b极的电极反应式为O2+4e-+2H2O=4OH-
C. 电解质溶液中的OH- 移向a极
D. 该传感器工作一段时间后,电解质溶液的pH值将变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应:2A(g)![]() B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
实验 序号 | 时间/min 浓度/molL-1 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 950 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)实验1中,在10~20 min内,以物质A表示的平均反应速率为____mol·L-1·min-l,50 min时,v(正)____(填“<”“>”或“=”)v(逆)。
(2)0~20 min内,实验2比实验1的反应速率_____(填“快”或“慢”),其原因可能是______。
(3)实验3比实验1的反应速率____(填“快”或“慢”),其原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1 mol·L1稀盐酸,CO2的生成量与加入盐酸的体积的关系如图。下列判断正确的是
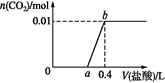
A. 在0~a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:![]()
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,常用Fe2(SO4)3溶液作腐蚀液,腐蚀铜质电路板得到废液主要成分是FeSO4和CuSO4,含少量Fe2(SO4)3。某学习小组设计装置从废液中提取铜,如图所示。已知:Fe2+失电子能力比OH- 强。下列说法正确的是

A. 电解初期阴极没有铜析出,原因是2H++2e-=H2↑
B. 石墨极的电极反应式为2H2O+4e-=4H++O2↑
C. 若电路中转移2mol电子,理论上有2molM从交换膜左侧向右侧迁移
D. 若将废液2充入阳极室时可再生腐蚀液(硫酸铁溶液)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com