
【题目】为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验,将乙醇与浓硫酸的混合液加热至170℃,将生成的气体通入溴水中,发现溴水褪色,即证明乙烯与溴水发生了加成反应.
(1)写出甲同学实验中两个主要的化学方程式_______________;___________;
(2)乙同学在甲同学的实验中发现,生成的气体有刺激性气味,推测产生的气体除乙烯外,还有副产物SO2 和CO2,SO2也能使溴水褪色:SO2+Br2+2H2O→H2SO4+2HBr
于是对甲同学的结论提出质疑;为确认乙烯能使溴水褪色,甲同学在实验时先将混合气体通过足量的_________(填序号)以除去其中的SO2,再通入溴水时发现剩余气体仍能使溴水褪色.
(A)氯水 (B)NaOH溶液 (C)酸性KMnO4溶液
(3)乙同学又提出质疑,认为乙烯使溴水褪色也可能发生了取代反应:CH2=CH2+Br2→CH2=CHBr+HBr
甲同学认为很有道理,于是又做了一个简单的实验来确认是否发生取代反应,该实验所用的试剂是_________,可能的现象和结论是______________________________________________________。
【答案】 CH3CH2OH![]() CH2=CH2↑+H2O CH2=CH2+Br2→CH2BrCH2Br B 紫色石蕊试液 向反应后的溶液中滴加紫色石蕊试液,溶液不变红,说明该反应为加成反应而非取代反应
CH2=CH2↑+H2O CH2=CH2+Br2→CH2BrCH2Br B 紫色石蕊试液 向反应后的溶液中滴加紫色石蕊试液,溶液不变红,说明该反应为加成反应而非取代反应
【解析】(1)利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生了消去反应:CH3CH2OH![]() CH2=CH2↑+H2O;溴水中的溴与乙烯发生加成反应,即CH2=CH2+Br2→CH2BrCH2Br;(2)(A)氯水与SO2能发生氧化还原反应,氯水与乙烯发生加成反应,所以氯水不能除去SO2;(B)NaOH溶液与SO2能发生反应生成亚硫酸钠,NaOH溶液与乙烯不反应,所以NaOH溶液能除去SO2; (C)酸性KMnO4溶液与SO2能发生氧化还原反应,酸性KMnO4溶液与乙烯发生氧化还原反应,所以酸性KMnO4溶液不能除去SO2;答案选B;(3)向反应后的溶液中滴加紫色石蕊试液,溶液不变红,说明该反应为加成反应而非取代反应。
CH2=CH2↑+H2O;溴水中的溴与乙烯发生加成反应,即CH2=CH2+Br2→CH2BrCH2Br;(2)(A)氯水与SO2能发生氧化还原反应,氯水与乙烯发生加成反应,所以氯水不能除去SO2;(B)NaOH溶液与SO2能发生反应生成亚硫酸钠,NaOH溶液与乙烯不反应,所以NaOH溶液能除去SO2; (C)酸性KMnO4溶液与SO2能发生氧化还原反应,酸性KMnO4溶液与乙烯发生氧化还原反应,所以酸性KMnO4溶液不能除去SO2;答案选B;(3)向反应后的溶液中滴加紫色石蕊试液,溶液不变红,说明该反应为加成反应而非取代反应。


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:
【题目】某晶体的下列性质可作为判断它是离子晶体的充分依据的是( )
A.具有较高的熔点和较大的硬度
B.固态不导电,其水溶液能导电
C.可溶于水
D.固态不导电,熔融态能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化学用语是学习和研究化学的工具,请用化学用语填空: ①两个氢分子;②氦气;
③亚铁离子;④标出氨气中氮元素的化合价 .
【答案】2H2|He|Fe2+| ![]()
(1)在O2、CO2、H2O2三种物质中都含有 , 三种物质的一个分子中都含有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,用排饱和食盐水法先后收集20ml CH4和 80mlCl2,放在光亮的地方(注意:不要放在日光直射的地方,以免引起爆炸),等待片刻,观察发生的现象.回答下列问题:
(1)大约30min后,可以观察到量筒壁上出现___________液体,该现象说明生成了______(填序号)
①CH3Cl ②CH2Cl2 ③CHCl3 ④CCl4
量筒内出现的白雾是___________,量筒内液面___________(填“上升”、“下降”或“不变”),
(2)液化石油气的主要成分是丙烷,试写出丙烷燃烧的化学方程式______________________;将现用液化石油气的燃具改用天然气时应___________进空气的风口.(填增大或减少)
(3)下列烷烃的分子式有 3种同分异构体的是___________.(填字母)
A.C5H12 B.C4H10 C.C3H8 D.C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】扁桃酸衍生物是重要的医药中间体,以A、B为原料合成扁桃酸衍生物F路线如下:
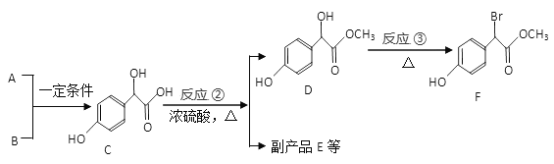
(1) A 的分子式为C2H2O3,1molA 能消耗含有2.5 molCu(OH)2 新制悬浊液,写出反应①的化学方程式_______________________________。
(2)化合物C 所含官能团名称为______________,在一定条件下C 与足量NaOH 溶液反应,1molC 最多消耗NaOH 的物质的量为_________________mol。
(3)反应②的反应类型为___________; 请写出反应③的化学方程式_____________________________。
(4)E 是由2 个分子C生成的含有3 个六元环的化合物,E 的分子式为____________________。
(5)符合条件的F 的所有同分异构体(不考虑立体异构) 有__________种,其中核磁共振氢谱有五组峰的结构简式为____________________。
①属于一元酸类化合物; ②苯环上只有2 个取代基 ③遇FeCl3 溶液显紫色
(6)参照上述合成路线。以冰醋酸为原料(无机试剂任选)设计制备A 的合成路线。己知RCH2COOH ![]() RCH(Cl)COOH______________________
RCH(Cl)COOH______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的说法错误的是( )
A.将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照
B.无色溶液中加Ba(NO3)2溶液,再加稀盐酸,沉淀不溶解,不能说明原溶液中一定有SO42﹣
C.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的 ![]() ,液体也不能蒸干
,液体也不能蒸干
D.将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个体重50kg的健康人体内含铁元素2g,这2g铁元素以Fe2+和Fe3+的形式存在.Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4).服用维生素C可使食物中的Fe3+转化成Fe2+ , 有利于人体对铁的吸收.请回答下列问题:
(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是 .
A.Fe
B.Fe2+
C.Fe3+
(2)维生素C可使食物中的Fe3+转化为Fe2+ , 在此过程中是氧化剂,说明维生素C具有性.
(3)在人体中进行Fe2+ ![]() Fe3+的转化时,
Fe3+的转化时,
①反应中的Fe2+发生反应,②反应中的Fe3+被 .
(4)市场上出售的某种麦片中含有微量的颗粒细小的还原性铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐.此反应的化学方程式为 , 离子方程式为 .
(5)己知下列反应:
①H2O2+2Fe3+=2Fe2++O2↑+2H+②2Fe2++H2O2+2H+=2Fe3++2H2O
反应①中生成1molO2转移电子的物质的量为 , 反应①、②的总反应方程式为 ,
在该反应中Fe3+的作用为 .
(6)在Fe+4HNO3=Fe(NO3)3+NO↑+2H2O的反应中,HNO3表现了性和性,毎有1molFe参加反应转移电子mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,向100 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图所示。下列分析正确的是

A. a点对应溶液的导电性比d点强
B. 氢硫酸的酸性比亚硫酸的酸性强
C. 向d点对应的溶液中加入Ba(NO3)2溶液,产生BaSO4白色沉淀
D. H2S饱和溶液的物质的量浓度为0.05 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com