
【题目】物质结构与性质下表为元素周期表的一部分。请回答下列问题:
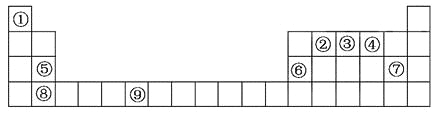
(1)上述元素中,属于s区的是_________(填元素符号)。
(2)写出元素⑨的基态原子的价电子排布图_______。
(3)元素的第一电离能:③______④(选填“大于”或“小于”)。
(4)元素③气态氢化物的VSEPR模型为____;该分子为___分子(选填“极性”或“非极性”)。向硫酸铜溶液中逐滴加入其水溶液,可观察到的现象为_____________。
(5)元素⑥的单质的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
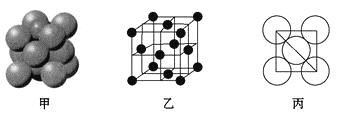
若已知⑥的原子半径为dcm,NA代表阿伏加德罗常数,元素⑥的相对原子质量为M,请回答:晶胞中⑥原子的配位数为____________,该晶体的密度为___________(用字母表示)。
【答案】H、Mg、Ca 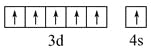 大于 四面体形 极性 先产生蓝色沉淀,后溶解得深蓝色溶液 12
大于 四面体形 极性 先产生蓝色沉淀,后溶解得深蓝色溶液 12 ![]() g·cm-3(或
g·cm-3(或 g·cm-3)
g·cm-3)
【解析】
(1)区的名称来自于按照构造原理最后填入电子的轨道名称,因此上述元素中,属于s区的是H、Mg、Ca;
(2)元素⑨是Cr,原子序数是24,所以根据核外电子排布规律可知基态原子的价电子排布图为 ;
;
(3)③④分别是N和O,非金属性越强,第一电离能越大。但由于氮元素的2p轨道电子处于半充满状态,稳定性强,第一电离能大于氧元素,则元素的第一电离能:③大于④;
(4)元素③气态氢化物是氨气,其中氮元素含有1对孤对电子,价层电子对数是3,所以的VSEPR模型为四面体形;由于实际构型是三角锥形,所以该分子为极性分子。氨气能与铜离子形成配位健,则向硫酸铜溶液中逐滴加入其水溶液,可观察到的现象为先产生蓝色沉淀,后溶解得深蓝色溶液;
(5)元素⑥是Al,根据晶胞结构可知以顶点为中心,与该点距离最近的铝原子有12个,所以晶胞中⑥原子的配位数为12;若已知⑥的原子半径为dcm,则面对角线是4dcm,则边长是![]() ,体积是
,体积是![]() 。晶胞中铝原子的个数=
。晶胞中铝原子的个数=![]() ,则该晶体的密度为
,则该晶体的密度为![]() =
= g·cm-3。
g·cm-3。


科目:高中化学 来源: 题型:
【题目】已知反应I2(g)+H2(g) ![]() 2HI(g) ΔH<0,下列说法正确的是( )
2HI(g) ΔH<0,下列说法正确的是( )
A.降低温度,正向反应速率减小倍数大于逆向反应速率减小倍数
B.升高温度将缩短达到平衡的时间
C.达到平衡后,保持温度和容积不变,充入氩气,正、逆反应速率同等倍数增大
D.达到平衡后,保持温度和压强不变,充入氩气,HI的质量将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能正确表达反应颜色变化的是
A. 向CuSO4溶液中加入足量Zn粉,溶液蓝色消失Zn+CuSO4![]() Cu+ZnSO4
Cu+ZnSO4
B. 澄清的石灰水久置后出现白色固体Ca(OH)2+CO2![]() CaCO3↓+H2O
CaCO3↓+H2O
C. Na2O2在空气中放置后由淡黄色变为白色2Na2O2![]() 2Na2O+O2↑
2Na2O+O2↑
D. 向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀3Mg(OH)2+2FeCl3![]() 2Fe(OH)3+3MgCl2
2Fe(OH)3+3MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图的实验装置可用于研究SO2转化为SO3的转化率。已知:SO3的熔点是16.8℃,沸点是44.8℃。A处为SO2气体发生装置,C处为SO2与O2反应的装置。
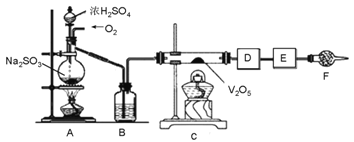
完成下列填空:
(1).A处的化学反应方程式为__________________,仪器F的名称为___________________________。
(2).根据实验需要,应该在D、E处连接合适的装置。请从下图中选择,将所选装置的序号填入相应的空格,D:________________,E:______________。

(3).用amolNa2SO3粉末与足量浓硫酸进行此实验,当A处反应结束时,再继续通入一段时间O2,最后测得E处装置增重bg,则此时SO2的转化率为_____%(用含a、b的代数式表示)。
(4).若Na2SO3变质,会影响到SO2的转化。现欲检验某Na2SO3样品是否变质,你的方法是____________________________________________________________________________________________。
(5).实验结束后,如果将收集了SO3的装置敞口露置于空气中,可看到装置出口处产生大量白雾,其原因是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )
X | ||
Y | ||
Z | M |
A.电负性:Y>Z>M
B.离子半径:M->Z2->Y-
C.ZM2分子中各原子的最外层均满足8电子稳定结构
D.Z元素基态原子最外层电子排布图为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,可逆反应:A2(g)+ B2(g)![]() xC(g) 符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是
xC(g) 符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是
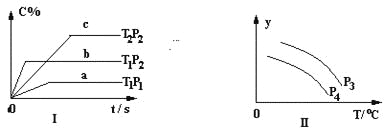
A. P3<P4,Y轴表示A2的转化率
B. P3<P4,Y轴表示A2的浓度
C. P3>P4,Y轴表示混合气体的密度
D. P3>P4,Y轴表示混合气体的平均摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】干燥的二氧化碳和氮气反应可生成氨基甲酸铵固体,化学方程式为:![]()
![]() ,在四氯化碳中通入二氧化碳和氨制备氨基甲酸铵的实验装置如下图所示,回答下列问题:
,在四氯化碳中通入二氧化碳和氨制备氨基甲酸铵的实验装置如下图所示,回答下列问题:

(1)装置1用来制备二氧化碳气体:将块状石灰石放置在试管中的带孔塑料板上,漏斗中所加试剂为____;装置2中所加试剂为____;
(2)装置4中试剂为固体NH4Cl和Ca(OH)2,发生反应的化学方程式为________;试管口不能向上倾斜的原因是__________。装置3中试剂为KOH,其作用为______________。
(3)反应时三颈瓶需用冷水浴冷却,其目的是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环氧树脂因其具有良好的机械性能、绝缘性能以及与各种材料的粘结性能,已广泛应用于涂料和胶黏剂等领域。下面是制备一种新型环氧树脂G的合成路线:


已知以下信息:

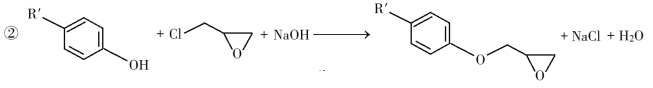
 回答下列问题:
回答下列问题:
(1)A是一种烯烃,化学名称为__________,C中官能团的名称为__________、__________。
(2)由B生成C的反应类型为__________。
(3)由C生成D的反应方程式为__________。
(4)E的结构简式为__________。
(5)E的二氯代物有多种同分异构体,请写出其中能同时满足以下条件的芳香化合物的结构简式__________、__________。
①能发生银镜反应;②核磁共振氢谱有三组峰,且峰面积比为3∶2∶1。
(6)假设化合物D、F和NaOH恰好完全反应生成1 mol单一聚合度的G,若生成的NaCl和H2O的总质量为765g,则G的n值理论上应等于__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于取代反应的是( )
①CHCl3+Cl2![]() CCl4+HCl
CCl4+HCl
②2HI+Cl2=2HCl+I2
③CH4+2O2![]() CO2+2H2O
CO2+2H2O
④CH3CH2CN+Cl2![]()
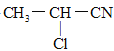 +HCl
+HCl
⑤CH3CH2OH+HBr![]() CH3CH2Br+H2O
CH3CH2Br+H2O
A.仅①B.仅①②③④C.仅①④⑤D.仅②④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com