
【题目】一定条件下,向容器中同时通入甲烷、氧气和水蒸气三种气体,发生的化学反应有:
反应过程 | 化学方程式 | 焓变
| 活化能
|
甲烷氧化 |
|
|
|
|
|
| |
蒸汽重整 |
|
|
|
|
|
|
(1)已知:![]() ,则
,则![]() 燃烧热
燃烧热![]() _____。
_____。
(2)在初始阶段,甲烷蒸汽重整的反应速率小于甲烷氧化的反应速率,原因可能是______。
(3)恒温恒压体系(温度为![]() ,压强为
,压强为![]() ),反应
),反应![]() 达到平衡时,各气体的物质的量均为
达到平衡时,各气体的物质的量均为![]() ,用某气体组分
,用某气体组分![]() 的平衡分压(分压=总压×物质的量分数)代替物质的量浓度
的平衡分压(分压=总压×物质的量分数)代替物质的量浓度![]() 也可表示平衡常数(记作
也可表示平衡常数(记作![]() )。则:
)。则:
①平衡常数![]() ___。
___。
②再向容器中瞬时同时充入![]() 、
、![]() 、
、![]() 、
、![]() ,此时
,此时![]() (正)____
(正)____![]() (逆)(填“>”“<”或“=”)
(逆)(填“>”“<”或“=”)
③恒温恒容条件下,将![]() 、
、![]() 、
、![]() 、
、![]() 按照体积比
按照体积比![]() 投料,能判断反应
投料,能判断反应![]() 达到平衡状态的是____。
达到平衡状态的是____。
A 密度保持不变 B ![]() 体积分数保持不变
体积分数保持不变
C 平均摩尔质量保持不变 D ![]() 和
和![]() 的比保持不变
的比保持不变
E ![]() 断裂的同时,有
断裂的同时,有![]() 断裂
断裂
(4)向绝热恒容密闭容器中通入![]() 和
和![]() 使反应
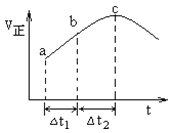
使反应![]() 达到平衡,正反应速率随时间变化的示意图如图所示。图中
达到平衡,正反应速率随时间变化的示意图如图所示。图中![]() 点反应是否达到平衡,说明理由_____。
点反应是否达到平衡,说明理由_____。
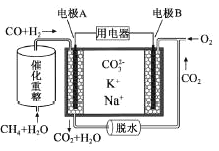
(5)利用重整反应![]() ,设计一种熔融碳酸盐燃料电池,原理示意图,电极
,设计一种熔融碳酸盐燃料电池,原理示意图,电极![]() 上发生的电极反应为______。
上发生的电极反应为______。
【答案】![]() 重整反应活化能高(或开始时重整反应物浓度低;或开始时体系不能提供重整所需的热能等其他合理答案)
重整反应活化能高(或开始时重整反应物浓度低;或开始时体系不能提供重整所需的热能等其他合理答案) ![]() (或
(或![]() ) < BCDE
) < BCDE ![]() 点不是平衡点,因为达到平衡后,正反应速率不会随着时间变化而变化(仅判断,不给分。其他合理答案也给分)
点不是平衡点,因为达到平衡后,正反应速率不会随着时间变化而变化(仅判断,不给分。其他合理答案也给分) ![]()
【解析】
(1)设![]()
![]() =-802.6kJ/mol为式①,
=-802.6kJ/mol为式①,
![]()
![]() =-322.0kJ/mol为式②,
=-322.0kJ/mol为式②,
![]() 为式③,则H2的燃烧热方程式H2(g)+
为式③,则H2的燃烧热方程式H2(g)+![]() O2(g)=H2O(l)可以由
O2(g)=H2O(l)可以由![]() (①-②) -③得出,故该反应的
(①-②) -③得出,故该反应的![]() =-284.3kJ/mol;
=-284.3kJ/mol;
(2)由表中数据可知,甲烷氧化的活化能低于蒸气重整的活化能,活化能越低,反应速率越快,故初始阶段,甲烷蒸汽重整的反应速率小于甲烷氧化的反应速率;
(3)①达到平衡时,各气体的物质的量均为![]() ,所以每个组分的分压都是
,所以每个组分的分压都是![]() ,所以
,所以 ;
;
②若向容器中瞬时同时充入![]() 、
、![]() 、
、![]() 、
、![]() ,总物质的量为10mol,CH4、H2O、CO、H2的分压分别为
,总物质的量为10mol,CH4、H2O、CO、H2的分压分别为![]() 、
、![]() 、
、![]() 、
、![]() ,此时用压强表示体系的浓度商为
,此时用压强表示体系的浓度商为 ,
,![]() >
>![]() ,故平衡向逆向移动,
,故平衡向逆向移动,![]() (正)<
(正)<![]() (逆);
(逆);
③判定反应达到平衡状态有两种方法,一是v正=v逆,二是变量不变;
A.密度![]() ,恒容条件下V是定值,根据质量守恒,气体的总质量m也是定值,故
,恒容条件下V是定值,根据质量守恒,气体的总质量m也是定值,故![]() 是定值,A不能判定平衡;
是定值,A不能判定平衡;
B.随着反应的进行,CO体积分数不断变化,当它不再变化时,说明反应达到平衡状态,B能判定平衡;
C.平均摩尔质量![]() ,m为定值,但反应前后系数之和不同,即n是变量,故M也是变量,C可以判定平衡;
,m为定值,但反应前后系数之和不同,即n是变量,故M也是变量,C可以判定平衡;
D.![]() 和
和![]() 的投料比为3:1,反应比为1:3,故比值不是定值,D可以判定平衡;
的投料比为3:1,反应比为1:3,故比值不是定值,D可以判定平衡;
E.![]() 断裂说明反应了1molH2O,是正反应方向,
断裂说明反应了1molH2O,是正反应方向,![]() 断裂说明反应了3molH2,是逆反应方向,故v正=v逆,E可以判定平衡;
断裂说明反应了3molH2,是逆反应方向,故v正=v逆,E可以判定平衡;
故选BCDE。
(4)化学平衡状态的标志是各物质的浓度不再改变,其实质是正反应速率等于逆反应速率,c点对应的正反应速率还在改变,故一定未达平衡;
(5)由图可知,H2和CO在A极上失电子生成CO2和H2O,故A是负极,那么B就是正极,在B极上,O2得电子与CO2生成![]() ,电极反应为:
,电极反应为:![]() ;
;


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2在密闭容器反应,达到平衡状态的标志是()
2NO+O2在密闭容器反应,达到平衡状态的标志是()
(1)单位时间内生成n mol O2的同时生成2n mol NO2
(2)单位时间内生成n mol O2的同时生成2n mol NO
(3)用NO2、NO、O2的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态.
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某简单(单核)粒子的原子核外有10个电子。
(1)若为原子,请画出其原子结构示意图______________。
(2)若为阳离子,请写出其常见的离子符号______________。
(3)若为阴离子,请写出其常见的离子符号______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.原子核都是由质子和中子构成的
B.一个氕原子核实际上就是一个质子
C.某原子的相对原子质量就是该原子的质量与一个碳—12原子质量的比值
D.质量数是个化学概念,某元素的质量与该元素的近似相对原子质量在数值上相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10mL 0.1 molL1一元弱碱XOH溶液中逐滴滴加0.1 molL1的HCl溶液,溶液的变化 如图所示(溶液混合时体积变化忽略不计)。下列说法正确的是( )
如图所示(溶液混合时体积变化忽略不计)。下列说法正确的是( )
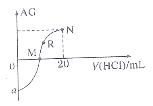
A.a的最小值是12
B.M点消耗盐酸的体积为10mL
C.R点溶液中可能存在![]()
D.M点到N点,水的电离程度逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,A元素的原子得2个电子、B元素的原子失去1个电子后所形成的微粒均与氩原子有相同的核外电子数。C元素的原子只有1个电子,A、D两元素原子核外电子总数比B元素原子质子数多9个。
(1)A的元素名称是_______,B的元素符号是______。
(2)D原子的原子结构示意图为____________,B+的离子结构示意图__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。
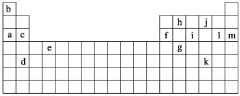
下列______(填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类最早使用的金属之一,铜的化合物丰富多彩。
⑴铜与N2O4在一定条件下可制备无水Cu(NO3)2。Cu在周期表中位于______区,基态Cu原子的电子排布式为______。NO3-的空间构型为_____。
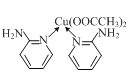
⑵邻氨基吡啶(![]() )的铜配合物在有机合成中有重要作用。 C、N、O的第一电离能由大到小的顺序为______;邻氨基吡啶的铜配合物结构简式如图所示,C原子轨道杂化类型为______;1 mol
)的铜配合物在有机合成中有重要作用。 C、N、O的第一电离能由大到小的顺序为______;邻氨基吡啶的铜配合物结构简式如图所示,C原子轨道杂化类型为______;1 mol ![]() 中σ键的数目为______mol。
中σ键的数目为______mol。
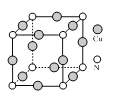
⑶如图是铜的一种氮化物晶体的晶胞结构。该化合物中Cu的化合价是______,Cu和N原子的配位数之比是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是一种解毒药,用于氟化物、砷、汞、铅、锡、碘等中毒,临床常用于治疗荨麻疹,皮肤瘙痒等病症.硫代硫酸钠在中性或碱性环境中稳定,在酸性溶液中分解产生S和SO2
实验I:Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示:

(1)仪器a的名称是_______,仪器b的名称是_______。b中利用质量分数为70%80%的H2SO4溶液与Na2SO3固体反应制备SO2反应的化学方程式为_______。c中试剂为_______
(2)实验中要控制SO2的生成速率,可以采取的措施有_______ (写出一条)
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是_______
实验Ⅱ:探究Na2S2O3与金属阳离子的氧化还原反应。
资料:Fe3++3S2O32-Fe(S2O3)33-(紫黑色)
装置 | 试剂X | 实验现象 |
| Fe2(SO4)3溶液 | 混合后溶液先变成紫黑色,30s后几乎变为无色 |
(4)根据上述实验现象,初步判断最终Fe3+被S2O32-还原为Fe2+,通过_______(填操作、试剂和现象),进一步证实生成了Fe2+。从化学反应速率和平衡的角度解释实验Ⅱ的现象:_______
实验Ⅲ:标定Na2S2O3溶液的浓度
(5)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量为294gmol-1)0.5880g。平均分成3份,分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72-+14H+ = 3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应I2+2S2O32- = 2I- + S4O62-,三次消耗 Na2S2O3溶液的平均体积为25.00 mL,则所标定的硫代硫酸钠溶液的浓度为_______molL-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com