
【题目】(1)①写出重晶石的化学式:____________;
②写出甘油的结构简式:____________。
(2)写出FeCl3与KI反应的离子方程式:____________。
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
【题目】砷及其化合物有着广泛的用途。砷有两种常见的弱酸,砷酸(H3AsO4)和亚砷酸(H3AsO3)。已知砷酸(H3AsO4)的pKa1、pKa2、pKa3依次为2.25、6.77、11.40(pKa=-lgKa)。回答下列问题:
(1)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s)ΔHl
H2(g)+2O2(g)=H3AsO4(s)ΔHl
H2(g)+![]() O2(g)=H2O(1)ΔH2
O2(g)=H2O(1)ΔH2
As(s)+ ![]() O2(g)=
O2(g)= ![]() As2O5(s) ΔH3
As2O5(s) ΔH3
则反应As2O5(g)+3H2O(1)=2H3AsO4(s) ΔH=_________。
(2)写出砷酸(H3AsO4)的第二步电离方程式___________________________________。
(3)NaH2AsO4溶液呈______(填“酸性”、“中性”或“碱性”),试通过计算说明________________________。
(4)亚砷酸(H3AsO3)水溶液中存在多种微粒形态,各种微粒分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与溶液的pH关系如下图所示。
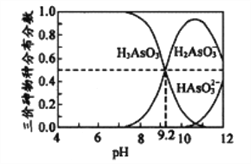
以酚酞为指示剂(变色范围pH8.2~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为__________________________。
(5)某化学兴趣小组同学欲探究可逆反应AsO33-+I2+2OH-![]() AsO43-+2I-+H2O。设计如下图I所示装置。实验操作及现象:按图I装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图I装置左边烧杯中逐滴加入一定量2mol/L盐酸,发现又产生电流,实验中电流与时间的关系如图II所示。
AsO43-+2I-+H2O。设计如下图I所示装置。实验操作及现象:按图I装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图I装置左边烧杯中逐滴加入一定量2mol/L盐酸,发现又产生电流,实验中电流与时间的关系如图II所示。
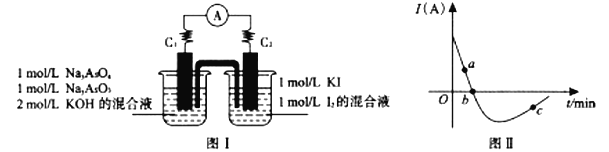
①图II中AsO43-的逆反应速率:a____b(填“>”、”<”或“=”)。
②写出图II中c点对应图I装置的正极反应式__________________________。
③能判断该反应达到平衡状态的是________________。
a.2v(I-)正=v(AsO33-)逆 b.溶液的pH不再变化
c.电流表示数变为零 d.溶液颜色不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“银-Ferrozine”法检测室内甲醛含量的原理如下:

下列说法错误的是( )
A. 标准状况下,11.2LCO2中含碳氧双键的数目为6.02×1023
B. 30gHCHO被氧化时转移电子数目为4×6.02×1023
C. 反应①的化学方程式为2Ag2O+HCHO=4Ag+CO2+H2O
D. 理论上,吸收HCHO 与消耗Fe3+的物质的量之比为4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①泥浆中泥沙是溶质,水是溶剂
②医用酒精中,水是溶剂,酒精是溶质
③凡是分散质能通过半透膜的分散系即属于胶体
④通过丁达尔现象可以鉴别胶体和溶液.
A.①②③④
B.②④
C.②③
D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1 mol·L1的盐酸滴定20 mL约0.1 mol·L1氨水,滴定曲线如图所示,下列说法正确的是
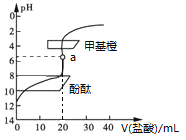
A. a点溶液中:c(H+)=c(OH)+c(NH3·H2O)
B. 滴定过程中,当溶液的pH=7时,两者恰好中和
C. 用酚酞作指示剂比用甲基橙作指示剂,滴定误差更小
D. 当滴入盐酸为30 mL时,溶液中:c(NH4+)+c(H+)<c(OH)+c(Cl)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用如图给定的仪器组成一套实验装置(各仪器只允许用一次),在室温、 1.01×105 Pa的条件下测定镁的相对原子质量。
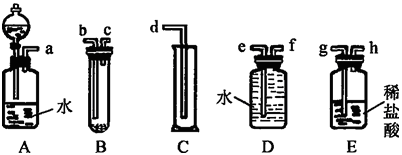
请回答下列问题:
(1)假设气流方向为左→右,则各仪器的接口连接的先后顺序为 (用小写字母填写)。
(2)连接好仪器后,要进行的操作有以下几步:
①待仪器B中的物质恢复至室温时,测量量筒 C中水的体积(假定将测定的体积换算成标准状况下为 V mL);
②擦掉镁条表面的氧化膜,将其置于天平上称量(假定其质量为m g,并将其放入试管B中);
③检查各装置的气密性;
④旋开仪器A上分液漏斗的活塞,当镁条完全溶解时再关闭活塞。
上述几步操作的先后顺序是 。
(3)根据实验数据可计算出镁的相对原子质量,其数学表达式为 。
(4)若未将试管B冷却至室温就测量量筒C中水的体积,这将会使所测镁的相对原子质量数据 (填“偏大”“偏小”或“无影响”)。
(5)若未擦净镁条表面的氧化膜就进行实验,这将会使所测镁的相对原子质量数据 (填“偏大”“偏小”或“无影响”)。
(6)实验中需要用480 mL 1 mol/L的盐酸,配制过程中用于定容的玻璃仪器的规格和名称是
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积均为1 L的三个密闭容器中,分别放入铁粉并充入1 mol CO,控制在不同温度下发生反应:Fe(s)+5CO(g) ![]() Fe(CO)5(g),当反应进行到5min时,测得CO的体积分数与温度的关系如图所示。下列说法一定正确的是( )
Fe(CO)5(g),当反应进行到5min时,测得CO的体积分数与温度的关系如图所示。下列说法一定正确的是( )

A. 反应进行到5min时,b容器中v(正)=v(逆)
B. 正反应为吸热反应,平衡常数:K(T1)>K(T2)
C. b中v(正)大于a中v(逆)
D. 达到平衡时,a、b、c中CO的转化率为b>c>a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com