
【题目】用“银-Ferrozine”法检测室内甲醛含量的原理如下:

下列说法错误的是( )
A. 标准状况下,11.2LCO2中含碳氧双键的数目为6.02×1023
B. 30gHCHO被氧化时转移电子数目为4×6.02×1023
C. 反应①的化学方程式为2Ag2O+HCHO=4Ag+CO2+H2O
D. 理论上,吸收HCHO 与消耗Fe3+的物质的量之比为4∶1
【答案】D
【解析】A.标准状况下,11.2LCO2的物质的量是0.5mol,其中含碳氧双键的数目为6.02×1023,A正确;B.甲醛中C元素化合价为0价,被氧化为CO2,碳元素的化合价从0价升高到+4价,失去4个电子。30gHCHO的物质的量是1mol,被氧化时转移电子数目为4×6.02×1023,B正确;C.由流程可知Ag2O与HCHO反应生成Ag、二氧化碳和水,则反应的方程式为2Ag2O+HCHO=4Ag+CO2+H2O,C正确;D.甲醛氧化为CO2,碳元素的化合价从0价升高到+4价,转移电子数为4,Fe3+反应生成Fe2+转移电子数为1,则理论上消耗的甲醛与消耗Fe3+的物质的量之比为1:4,D错误,答案选D。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】关于硅酸钠以下说法不正确的是( )
A. 硅酸钠与盐酸反应的离子方程式:SiO32—+2H+=H2SiO3↓
B. 硅酸钠溶液俗称“泡花碱”,其溶液显碱性,滴加酚酞显红色
C. Na2CO3+SiO2 ![]() Na2SiO3+CO2↑,说明硅酸酸性比碳酸强
Na2SiO3+CO2↑,说明硅酸酸性比碳酸强
D. 水玻璃久置在空气中变质,因为与空气中的CO2发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修3:物质结构与性质]
文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的。青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素。
(1)硅元素基态原子的价电子轨道表示式为____________。
(2)第四周期中,与铝未成对电子数相同的金属元素有________种。
(3)Na+和Ne互为等电子体,电离能I2(Na)________I1(Ne)(填“>”或“<”)。
(4)①已知氯有多种含氧酸,其电离平衡常数如下:
化学式 | HClO4 | HClO3 | HClO2 | HClO |
Ka | 1×1010 | 1×101 | 1×10-2 | 4×10-8 |
HClO4的结构简式为_________,HClO3中Cl原子的杂化轨道类型为________,HClO2中含有的共价键类型为__________。以上几种含氧酸的酸性强弱不同,其原因为______________。
②氢卤酸(HX)的电离过程如图。ΔH1和ΔH2的递变规律都是HF>HCl>HBr>HI,其中ΔH1(HF)特别大的原因为_________,影响ΔH2递变的因素为______________。

(5)铝单质为面心立方晶体,晶胞参数a=q nm,铝的摩尔质量为Mg·mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA。则铝单质的密度为________g·cm-3(列式即可,下同),铝晶胞中原子的体积占晶胞体积的百分率为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不属于配合物的是( )
A. [Cu(H2O)4]SO4·H2O B. [Ag(NH3)2]OH
C. KAl(SO4)2·12H2O D. Na[Al(OH)4]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。
![]()
![]()
![]()
![]()
![]()
试回答:
(1)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为________;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示)________________,检验此C溶液中金属元素价态的操作方法是__________。
(2)若A、B、C为含有金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为________,X的化学式可能为(写出不同类物质)________或________,反应①的离子方程式为____________或_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四甲基氢氧化铵[(CH3)4NOH]常用作电子工业清洗剂,以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成(CH3)4NOH,其工作原理如下图所示(a、b为石墨电板,c、d、e为离子交换膜),下列说法正确的是( )
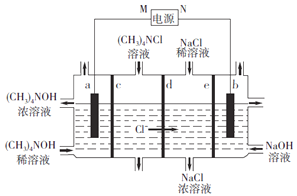
A. M为正极 B. c、e均为阳离子交换膜
C. b极电极反应式:2H2O-4e-=O2↑+4H+ D. 制备1mol(CH3)4NOH,a、b两极共产生0.5mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电动汽车配载一种可充放电的锂离子电池。放电时电池的总反应为:Li1-xCoO2+LixC6=LiCoO2+ C6(x<1)。下列关于该电池的说法不正确的是
A. 放电时,Li+在电解质中由负极向正极迁移
B. 充电时,若转移1mole-,石墨C6电极将增重7xg
C. 放电时,负极的电极反应式为LixC6-xe-= xLi++ C6
D. 充电时,阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①写出重晶石的化学式:____________;
②写出甘油的结构简式:____________。
(2)写出FeCl3与KI反应的离子方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下发生反应2SO3(g)![]() 2SO2(g)+O2(g),将1molSO3气体通入1L容积恒定的密闭容器中,维持容器内温度不变,5min末测得SO3的物质的量为0.4mol。则下列说法正确的是( )
2SO2(g)+O2(g),将1molSO3气体通入1L容积恒定的密闭容器中,维持容器内温度不变,5min末测得SO3的物质的量为0.4mol。则下列说法正确的是( )
A. 0~5min,O2的生成速率v(O2)=0.06mol·L-1·min-1
B. 若起始时充入3molSO3,起始时SO3分解速率不变
C. 若某时刻消耗了0.5molSO3同时生成了0.25molO2,则表明该反应达到了平衡状态
D. 达到平衡时,SO2和SO3的浓度相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com