
【题目】关于硅酸钠以下说法不正确的是( )
A. 硅酸钠与盐酸反应的离子方程式:SiO32—+2H+=H2SiO3↓
B. 硅酸钠溶液俗称“泡花碱”,其溶液显碱性,滴加酚酞显红色
C. Na2CO3+SiO2 ![]() Na2SiO3+CO2↑,说明硅酸酸性比碳酸强
Na2SiO3+CO2↑,说明硅酸酸性比碳酸强
D. 水玻璃久置在空气中变质,因为与空气中的CO2发生反应
科目:高中化学 来源: 题型:
【题目】关于同分异构体的叙述正确的是
A. 相对分子质量相同而结构不同的化合物互称为同分异构体
B. 化学式相同而结构不同的化合物互称为同分异构体
C. 同分异构体之间由于分子组成相同,所以它们的性质相同
D. 只有少数的有机物之间存在同分异构现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水CaCl2具有强烈的吸湿性,在空气中易潮解,可用作干燥剂、脱水剂、混凝防冻剂等。以工业碳酸钙矿石(含有少量SiO2 、Fe2O3、Al2O3、FeCO3等杂质)生产无水氯化钙的主要流程如下:
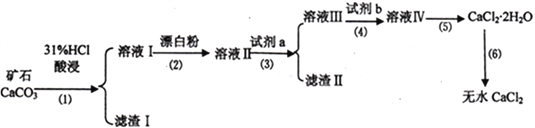
(1)为了提高步骤(1)的反应速率,可以采取的措施是________________________。
(2)加入试剂b 的目的是使溶液酸化,试剂b 可以选择下列试剂__________(填序号)。
①硫酸 ②硝酸 ③氢硫酸 ④盐酸
(3)写出步骤(2)的离子方程式______________________________。
(4)步骤(5)用到的操作方法有蒸发浓缩、______________________________。
(5)已知A13+、Fe2+、Fe3+生成氢氧化物沉淀的pH 如下:
Al (OH)3 | Fe(OH)2 | Fe(OH)3 | |||
开始沉淀 | 3.7 | 开始溶解 | 7.8 | 6.5 | 1.5 |
沉淀完全 | 5.3 | 完全溶解 | 10.0 | 9.7 | 3.3 |
加入试剂a的目的是调节溶液的pH,调节pH 的范围为_______________________________。
(6)已知某一温度时Ksp[Fe(OH)3]=8.0×10-38,向0.01 mol·L-1的FeCl3 溶液中加入NaOH 固体,假设溶液的体积不变,要生成Fe(OH)3沉淀,应使溶液中的c(OH-)最小为__________mol·L-1;Fe3+沉淀完全时,溶液中c(OH-) 最小为__________mol·L-1。
(7)测定样品中Cl-含量的方法是:a.称取0.7500g 样品,溶解,在250mL 容量瓶中定容;b.量取25.00mL 待测液于锥形瓶中; c.用0.05000mol·L-1AgNO3 溶液滴定至终点,消耗AgNO3溶液体积的平均值为25.00mL。计算上述样品中CaCl2 的质量分数为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知咖啡酸的结构如右图所示。关于咖啡酸的描述正确的是
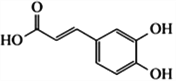
A. 与咖啡酸的官能团完全相同(不含咖啡酸),且苯环上只有3个取代基的同分异构体(不包括顺反异构)有11种
B. 咖啡酸的分子式为C9H6O4
C. 咖啡酸与![]() 互为同系物
互为同系物
D. 1mol 咖啡酸与足量NaHCO3溶液反应产生3mol 气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向20 mL 0.1 mol/L的醋酸溶液中不断滴入0.1 mol/L的NaOH溶液,溶液的pH变化曲线如图所示。在滴定过程中,关于溶液中离子浓度大小关系的描述正确的是
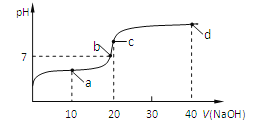
A.a点时:c(CH3COOH) c(CH3COO-) c(H+) c(Na+) c(OH-)
B.b点时:c(Na+)=c(CH3COO-)
C.c点时:c(H+)=c(CH3COOH)+c(OH-)
D.d点时:c(Na+) c(OH-) c(CH3COO-) c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、铝、铁是三种重要的金属。请回答:
(1)钠元素的金属性比铝的________(填“强”或“弱”)。
(2)将一小块金属钠投入水中,发生反应的离子方程式为______________________;可观察到的实验现象是________(填序号)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(3)呼吸面具的原理:________________,_______________________。
(4)填写a、b、c化学式并书写①、②的离子方程式(a、b、c均为含Al化合物);
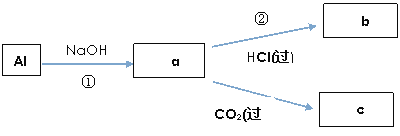
a:____________,b:_____________,c:____________;
①____________________________________________;
②____________________________________________;
(5)Fe跟Cl2在一定条件下反应,所得产物的化学式是________。将该产物溶于水配成溶液,分装在两支试管中。请回答:
a.若向其中一支试管中滴加KSCN溶液,则溶液变成________色。
b.向另一支试管中滴加NaOH溶液,现象为___________________________,反应的离子方程式是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫含量,采用以下方案:
甲方案:如下图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定二氧化硫的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。
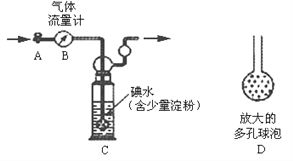
(1)洗气瓶C中发生反应的化学方程式为:_______________;
(2)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验准确度,其理由是:___________________;
(3)洗气瓶C溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量将_________(填“偏高”、“偏低”或“无影响”);
(4)下列试剂中,可以用来替代洗气瓶C中溶液的是_________。(选填字母编号)
a.NaOH溶液 b.品红溶液
c.酸性高锰酸钾溶液 d.Na2CO3溶液
乙方案:实验步骤如以下流程图所示:
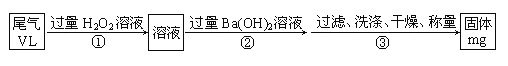
(5)写出步骤②中反应的离子方程式;_________________________
(6)通过的尾气体积为VL(已换算成标准状况)时,该尾气中二氧化硫含量(体积分数)为________________(用含V、m的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷及其化合物有着广泛的用途。砷有两种常见的弱酸,砷酸(H3AsO4)和亚砷酸(H3AsO3)。已知砷酸(H3AsO4)的pKa1、pKa2、pKa3依次为2.25、6.77、11.40(pKa=-lgKa)。回答下列问题:
(1)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s)ΔHl
H2(g)+2O2(g)=H3AsO4(s)ΔHl
H2(g)+![]() O2(g)=H2O(1)ΔH2
O2(g)=H2O(1)ΔH2
As(s)+ ![]() O2(g)=
O2(g)= ![]() As2O5(s) ΔH3
As2O5(s) ΔH3
则反应As2O5(g)+3H2O(1)=2H3AsO4(s) ΔH=_________。
(2)写出砷酸(H3AsO4)的第二步电离方程式___________________________________。
(3)NaH2AsO4溶液呈______(填“酸性”、“中性”或“碱性”),试通过计算说明________________________。
(4)亚砷酸(H3AsO3)水溶液中存在多种微粒形态,各种微粒分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与溶液的pH关系如下图所示。
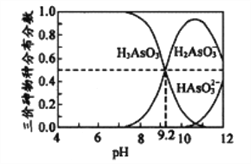
以酚酞为指示剂(变色范围pH8.2~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为__________________________。
(5)某化学兴趣小组同学欲探究可逆反应AsO33-+I2+2OH-![]() AsO43-+2I-+H2O。设计如下图I所示装置。实验操作及现象:按图I装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图I装置左边烧杯中逐滴加入一定量2mol/L盐酸,发现又产生电流,实验中电流与时间的关系如图II所示。
AsO43-+2I-+H2O。设计如下图I所示装置。实验操作及现象:按图I装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图I装置左边烧杯中逐滴加入一定量2mol/L盐酸,发现又产生电流,实验中电流与时间的关系如图II所示。
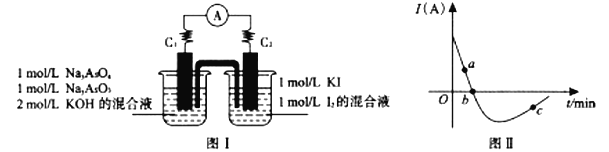
①图II中AsO43-的逆反应速率:a____b(填“>”、”<”或“=”)。
②写出图II中c点对应图I装置的正极反应式__________________________。
③能判断该反应达到平衡状态的是________________。
a.2v(I-)正=v(AsO33-)逆 b.溶液的pH不再变化
c.电流表示数变为零 d.溶液颜色不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“银-Ferrozine”法检测室内甲醛含量的原理如下:

下列说法错误的是( )
A. 标准状况下,11.2LCO2中含碳氧双键的数目为6.02×1023
B. 30gHCHO被氧化时转移电子数目为4×6.02×1023
C. 反应①的化学方程式为2Ag2O+HCHO=4Ag+CO2+H2O
D. 理论上,吸收HCHO 与消耗Fe3+的物质的量之比为4∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com