
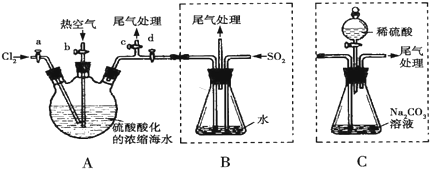


科目:高中化学 来源: 题型:
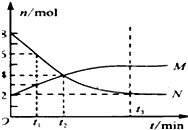 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A、反应的化学方程式为:N?2M |
| B、t2时,正逆反应速率相等,达到平衡 |
| C、平衡时,N的转化率是75% |
| D、t1分钟内,反应速率:v(M)=2v(N) |
查看答案和解析>>
科目:高中化学 来源: 题型:
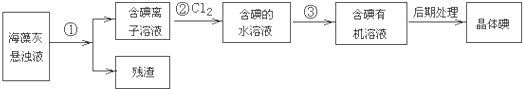
查看答案和解析>>
科目:高中化学 来源: 题型:
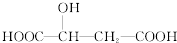 )说法正确的是( )
)说法正确的是( )| A、苹果酸不易溶于水而易溶于有机溶剂 |
| B、和苹果酸具有相同官能团的同分异构体只有1种 |
| C、1 mol苹果酸与足量NaOH溶液反应时,最多消耗3 mol NaOH |
| D、1mol苹果酸与足量NaHCO3溶液反应时,最多可得44.8LCO2(标准状况下) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SiO2晶体 |
| B、Ar晶体 |
| C、NaCl晶体 |
| D、NaOH晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com