
【题目】用KI溶液和FeCl3溶液进行如下实验。下列说法中错误的是 ( )

A.实验i发生的反应为:2Fe3++2I-2Fe2++I2
B.黄色溶液中含有Fe2+、Fe3+、Cl-、K+、I-离子
C.实验ⅲ水溶液中c(Fe2+)小于ⅰ中c(Fe2+)
D.若向实验ⅲ所得液体中滴加![]() 溶液,水层红色比实验ⅱ浅
溶液,水层红色比实验ⅱ浅
【答案】C
【解析】
KI溶液中加入少量氯化铁溶液,发生氧化还原反应,2Fe3++2I- =I2+2Fe2+,溶液分成二等份,一份溶液中滴加KSCN溶液,溶液变红色,证明含铁离子,另一份溶液中滴加1mLCCl4溶液,碘单质溶于四氯化碳,下层为紫红色的碘的四氯化碳溶液,据此分析解答。
A.KI溶液中I-具有还原性,FeCl3溶液中Fe3+具有氧化性,二者发生氧化还原反应,滴加的氯化铁是少量的,反应后的溶液中滴加KSCN溶液,溶液变红色,证明含铁离子,说明铁离子反应不完全,发生的反应是可逆的,即2Fe3++2I-2Fe2++I2,故A正确;
B.氯化铁(少量)和碘化钾之间的反应,产物是氯化亚铁、氯化钾,碘单质,并且碘化钾剩余,反应是可逆的,还存在少量的氯化铁,即黄色溶液中含有Fe2+、Fe3+、Cl-、K+、I-离子,故B正确;
C.实验iii中生成的I2萃取到CCl4层,从溶液中分离出产物I2,使反应2Fe3++2I-2Fe2++I2正向移动,使c(Fe2+)大于i中c(Fe2+),故C错误;
D.实验iii是向所得液体中滴加CCl4,萃取了碘单质,反应2Fe3++2I-2Fe2++I2正向移动,铁离子浓度减小,所得液体中滴加KSCN溶液,水层红色变浅,故D正确;
故选C。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】现有①氯化钡、②金刚石、③氯化铵、④硫酸钠、⑤干冰、⑥碘片六种物质,按下列要求回答:
(1)熔化时不需要破坏化学键的是________,熔化时需要破坏共价键的是________,熔点最高的是________,熔点最低的是________。
(2)属于离子化合物的是________,只有离子键的物质是________,以分子间作用力结合的是________。
(3)①的电子式是____________,⑥的电子式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里迅速制备少量氯气可利用如下反应:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,此反应不需加热,常温下就可以迅速进行,而且对盐酸的浓度要求不高。
(1)该反应中,氧化剂是________,还原剂是________。
(2)当参加反应的氧化剂的物质的量是1mol时,被氧化的还原剂的物质的量是________,产生的氯气在标准状况下的体积为________,电子转移数目为________。
(3)氯化氢在该反应过程中表现出的化学性质有________。
A 酸性B 还原性C 氧化性D 挥发性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物N具有镇痛、消炎等药理作用,其合成路线如下:
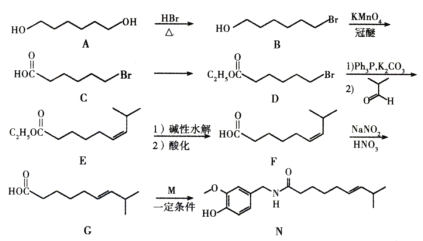
(1)A的系统命名为____________,E中官能团的名称为_____________。
(2)A→B的反应类型为____________,从反应所得液态有机混合物中提纯B的常用方法为_____________。
(3)C→D的的化学方程式为_____________。
(4)C的同分异构体W(不考虑手性异构)可发生银镜反应;且1 mol W最多与2 mol NaOH发生反应,产物之一可被氧化成二元醛。满足上述条件的W有____________种,若W的核磁共振氢谱具有四组峰,则其结构简式为_____________。
(5)参照上述合成路线,以![]() 为原料,采用如下方法制备医药中间体
为原料,采用如下方法制备医药中间体![]() 。
。
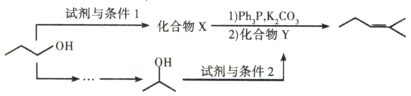
该路线中试剂条件1为____________,X的结构简式为____________;试剂与条件2为____________,Y的结构简式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锥形瓶中装有部分变质的漂粉精粉末和红色纸花,向其中注射浓盐酸,观察到纸花褪色,并有黄绿色气体生成,该实验可以得到的结论是( )
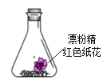
A.说明![]() 具有漂白性B.实验中只发生了氧化还原反应
具有漂白性B.实验中只发生了氧化还原反应
C.浓盐酸被氧化D.反应中生成的气体只有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种化合物(如图)由 W、X、Y、Z 四种短周期元素组成,其中 W、Y、Z 分别位于三个不同周期,Y 核外最外层电子数是 W 核外最外层电子数的二倍;W、X、Y 三种简单离子的核外电子排布相同。下列说法不正确的是

A.原子半径:W < X < Y < Z
B.X 与 Y、Y 与 Z 均可形成具有漂白性的化合物
C.简单离子的氧化性: W X
D.W 与 X 的最高价氧化物的水化物可相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不是氧化还原反应的是 ( )
①H2+Cl2![]() 2HCl
2HCl
②Na2CO3+2HCl=2NaCl+H2O+CO2↑
③2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
④CuO+2HNO3=Cu(NO3)2+H2O
⑤2HgO![]() 2Hg+O2↑
2Hg+O2↑
A.②④B.①③C.①②③D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法错误的是( )
A.乙烯、聚氯乙烯和苯中均含有碳碳双键
B.植物油含不饱和高级脂肪酸酯,能使![]() 的
的![]() 溶液褪色
溶液褪色
C.乙酸乙酯中混有的少量乙酸,可用饱和![]() 溶液除去
溶液除去
D.用酒精消毒,其原理是酒精使细菌中的蛋白质变性而失去生理活性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水CuCl2为棕黄色固体,用于颜料、木材防腐等工业,并用作消毒剂、媒染剂、催化剂等。实验室用如图所示装置制取CuCl2。(夹持装置省略)
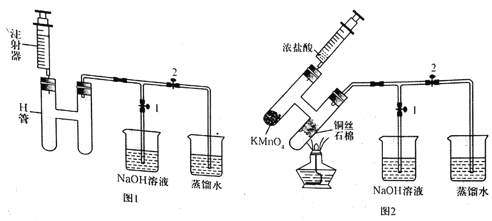
步骤1:制备时,首先按照图1所示连接实验装置。打开两处的止水夹,检验装置的气密性。
步骤2:用镊子向H管一端装入少量石棉,将其置于H管连通管以下部分且靠近连通管约![]() 处,将卷成团状的细铜丝置于石棉上。H管的另外一端装入少量KMnO4固体。在注射器中装入少量浓盐酸,待用。
处,将卷成团状的细铜丝置于石棉上。H管的另外一端装入少量KMnO4固体。在注射器中装入少量浓盐酸,待用。
步骤3:关闭止水夹2,打开止水夹1,将H管如图2所示倾斜放置,点燃酒精灯,加热铜丝直至其呈红热状态。立即将浓盐酸注入H管使其与KMnO4发生反应(注意调整H管倾斜度以利于浓盐酸的加入),观察到有黄绿色气体通过连通管部分进入H管另一端,继而与热铜丝燃烧得到产物。
待反应结束后,等待一段时间再打开止水夹2,关闭止水夹1,拉动注射器将蒸馏水慢慢的吸入H管中,在H管底部得到CuCl2溶液。最后进行尾气的处理操作。请回答以下有关问题。
(1)检验图1所示装置气密性时的操作方法是______。反应过程中将H管倾斜放置的目的是_________(写出一条即可)。
(2)浓盐酸与KMnO4反应的化学方程式为______。热铜丝燃烧得到产物时,铜丝上方的H管中观察到的现象是_____。反应结束后,“等待一段时间”再进行后续操作的原因是______。
(3)实验观察到蒸馏水慢慢地吸入H管中时,H管底部得到CuCl2溶液的颜色,有一个从黄绿色到绿色再到蓝绿色的变化过程。已知在溶液中[Cu(H2O)4]2+呈蓝色,[CuCl4]2-呈黄色。请用方程式表示溶液颜色变化的化学平衡体系:___。
(4)H管中铜丝不直接放置在右管底部的优点是___(写出两条即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com