
【题目】现有①氯化钡、②金刚石、③氯化铵、④硫酸钠、⑤干冰、⑥碘片六种物质,按下列要求回答:
(1)熔化时不需要破坏化学键的是________,熔化时需要破坏共价键的是________,熔点最高的是________,熔点最低的是________。
(2)属于离子化合物的是________,只有离子键的物质是________,以分子间作用力结合的是________。
(3)①的电子式是____________,⑥的电子式是____________。
【答案】⑤⑥ ② ② ⑤ ①③④ ① ⑤⑥ [C]-Ba2+[C]-
【解析】
(1)BaCl2属于离子晶体,金刚石属于原子晶体,NH4Cl、Na2SO4属于离子晶体,干冰属于分子晶体,碘晶体属于分子晶体,分子晶体熔化时不需要破坏化学键,原子晶体、离子晶体熔化时需要破坏化学键;一般物质熔点:原子晶体>离子晶体>分子晶体,分子晶体中相对分子质量越大,分子间作用力越强,物质的熔点越高;
(2)BaCl2、NH4Cl、Na2SO4属于离子化合物,BaCl2只含有离子键,分子晶体以分子间作用力结合;
(3)BaCl2为离子化合物,存在离子键;碘为非金属单质,以共用电子对成键。
(1)BaCl2属于离子晶体,金刚石属于原子晶体,NH4Cl、Na2SO4属于离子晶体,干冰属于分子晶体,碘晶体属于分子晶体,熔化时不需要破坏化学键的是干冰、碘晶体,熔化时需要破坏共价键的是金刚石,BaCl2、NH4Cl、Na2SO4熔化时破坏离子键,一般物质熔点:原子晶体>离子晶体>分子晶体,分子晶体中相对分子质量越大,分子间作用力越强,物质的熔点越高,故熔点最高的是金刚石,熔点最低的是干冰,故熔化时不需要破坏化学键的是⑤⑥,熔化时需要破坏共价键的是②,熔点最高的是②,熔点最低的是⑤;
(2)BaCl2、NH4Cl、Na2SO4属于离子化合物,NH4Cl含有离子键、共价键,而BaCl2只含有离子键,干冰、碘晶体以分子间作用力结合;
(3)BaCl2为离子化合物,其电子式为[C]-Ba2+[C]-;碘为非金属单质,以共用电子对成键,则电子式为![]() 。
。


 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是

A. a为负极,是铁片,烧杯中的溶液为硫酸
B. b为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C. a为正极,是碳棒,烧杯中的溶液为硫酸
D. b为正极,是碳棒,烧杯中的溶液为硫酸铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 表示阿伏加德罗常数的值。下列判断正确的是( )
表示阿伏加德罗常数的值。下列判断正确的是( )
A.在![]() 质量分数为
质量分数为![]() 的乙醇水溶液中,含氢原子总数为
的乙醇水溶液中,含氢原子总数为![]()
B.标准状况下,![]() 氟化氢中含有氟原子的数目为
氟化氢中含有氟原子的数目为![]()
C.![]() 的氢碘酸中含碘化氢分子数为
的氢碘酸中含碘化氢分子数为![]()
D.![]() 乙酸与足量乙醇发生酯化反应时断裂的
乙酸与足量乙醇发生酯化反应时断裂的![]() 键数为
键数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗(![]() )在自然界中非常分散,几乎没有比较集中的锗矿,因此被人们称为“稀散金属”。砷(
)在自然界中非常分散,几乎没有比较集中的锗矿,因此被人们称为“稀散金属”。砷(![]() )是第四周期VA族元素,可以形成
)是第四周期VA族元素,可以形成![]() 、
、![]() 、
、![]() 等化合物,用途广泛。完成下列填空:
等化合物,用途广泛。完成下列填空:
(1)已知锗元素与碳位于同一主族,与钙位于同一周期。
写出锗在周期表中的位置:____________。
根据锗在元素周期表中的位置写出锗的一条用途____________。
(2)将![]() 溶于浓盐酸,可以得到
溶于浓盐酸,可以得到![]() ,其沸点为
,其沸点为![]() 。
。
推测![]() 的晶体类型为______。
的晶体类型为______。
已知![]() 沸点高于
沸点高于![]() ,请从结构角度解释原因:____________。
,请从结构角度解释原因:____________。
将![]() 与
与![]() 作用可以得到
作用可以得到![]() ,
,![]() 水溶液呈______性(填“酸”“碱”或“中”)。
水溶液呈______性(填“酸”“碱”或“中”)。
(3)锗金属对人类具有保健功能,适宜人体接触佩戴。锗金属非常脆,容易破碎,一种常用的方法是将锗制成颗粒镶嵌到其他金属上,但存在易脱落的缺点。请提出一种改进建议:____________。
(4)砷原子核外有______个电子层,最外层有______个电子;比较溴、砷最高价氧化物对应水化物酸性的强弱:____________强于____________(填物质的化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱金属元素按原子序数增大,依次为:锂(![]() )、钠(
)、钠(![]() )、钾(
)、钾(![]() )、铷(
)、铷(![]() )、铯(
)、铯(![]() )、钫(
)、钫(![]() ,放射性元素)。请回答:
,放射性元素)。请回答:
(1) 钠钾合金许多特殊反应中有着非常重要的应用。取![]() 钠钾合金和一定量四氯化碳在一定条件下恰好完全反应,制造出
钠钾合金和一定量四氯化碳在一定条件下恰好完全反应,制造出![]() 纳米级金刚石粉末。则该钠钾合金中钠元素和钾元素的质量比为______。
纳米级金刚石粉末。则该钠钾合金中钠元素和钾元素的质量比为______。
(2)将一定量的铝和过氧化钠混合物投入一盛有![]() 蒸馏水的烧杯中,反应终止时得到一澄清溶液,所得溶液的质量比反应前上述三种物质总质量之和减少
蒸馏水的烧杯中,反应终止时得到一澄清溶液,所得溶液的质量比反应前上述三种物质总质量之和减少![]() ,再向所得溶液中滴加
,再向所得溶液中滴加![]() 盐酸直至产生的沉淀刚好溶解,消耗盐酸
盐酸直至产生的沉淀刚好溶解,消耗盐酸![]() 。求原混合物中
。求原混合物中![]() 和
和![]() 各多少克?____、____
各多少克?____、____
(3)一定条件下,![]() 铷与氧气和臭氧的混合气体
铷与氧气和臭氧的混合气体![]() (已折算为标况,且该混合气体对相同状况下氢气的相对密度为20.8)恰好完全反应,得到两种离子化合物
(已折算为标况,且该混合气体对相同状况下氢气的相对密度为20.8)恰好完全反应,得到两种离子化合物![]() 和
和![]() 的固体混合物。
的固体混合物。![]() 和
和![]() 中,阴阳离子个数比均为
中,阴阳离子个数比均为![]() 且均在两种微粒间作用力。已知
且均在两种微粒间作用力。已知![]() 的含氧量为0.3596。推断化合物
的含氧量为0.3596。推断化合物![]() 、
、![]() 的化学式分别为:____________、____________。
的化学式分别为:____________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各装置不能达到实验目的是
A.利用①吸收多余的氨气
B.装置②可用于除去Cl2中的HCl
C.装置③可用于干燥氨气
D.装置④可用于排空气法收集H2、CO2、Cl2、HCl等气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有氯化钠和碘化钠的混合物共26.7 g,溶于水,通入足量氯气后,蒸干、灼烧,固体质量变为 17.55 g。
(1)原混合物中碘化钠的质量是________。
(2)原混合物中氯化钠的质量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物广泛存在于自然界。请回答下列问题:
(1)反应Ⅰ:![]() △H1 平衡常数为K1
△H1 平衡常数为K1
反应Ⅱ:![]() △H2 平衡常数为K2
△H2 平衡常数为K2
不同温度下,K1、K2的值如下表:
| K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
现有反应Ⅲ:![]() ,结合上表数据,反应Ⅲ是________(填“放热”或“吸热”)反应。
,结合上表数据,反应Ⅲ是________(填“放热”或“吸热”)反应。
(2)![]() 催化加氢合成二甲醚是一种
催化加氢合成二甲醚是一种![]() 转化方法,其过程中主要发生下列反应:
转化方法,其过程中主要发生下列反应:
反应Ⅲ:![]() △H3
△H3
反应Ⅳ:![]() △H=-122.5kJ/mol
△H=-122.5kJ/mol
在恒压、![]() 和
和![]() 的起始量一定的条件下,
的起始量一定的条件下,![]() 平衡转化率和平衡时
平衡转化率和平衡时![]() 的选择性随温度的变化如图。
的选择性随温度的变化如图。
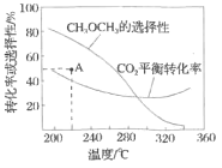
其中:![]() 的选择性
的选择性![]()
①温度高于300℃,![]() 平衡转化率随温度升高而上升的原因是________。
平衡转化率随温度升高而上升的原因是________。
②220℃时,在催化剂作用下![]() 与
与![]() 反应一段时间后,测得
反应一段时间后,测得![]() 的选择性为48%(图中
的选择性为48%(图中![]() 点)。不改变反应时间和温度,一定能提高
点)。不改变反应时间和温度,一定能提高![]() 选择性的措施有________。
选择性的措施有________。
(3)石油化工生产中,利用裂解反应可以获得重要化工原料乙烯、丙烯。一定条件下,正丁烷裂解的主反应如下:
反应Ⅴ:![]()
反应Ⅵ:![]()
一定温度下,向容积为![]() 的密闭容器中通入正丁烷,反应时间
的密闭容器中通入正丁烷,反应时间![]() 与容器内气体总压强
与容器内气体总压强![]() 数据如下:
数据如下:
| 0 | 10 | 20 | 30 | 40 |
| 5 | 7.2 | 8.4 | 8.8 | 8.8 |
①反应速率可以用单位时间内分压的变化表示,即v=![]() ,前
,前![]() 内正丁烷的平均反应速率v(正丁烷)
内正丁烷的平均反应速率v(正丁烷)![]() ________
________![]() ,该温度下,正丁烷的平衡转化率
,该温度下,正丁烷的平衡转化率![]() ________。
________。
②若平衡时乙烯的体积分数为![]() ,则该温度下反应Ⅴ的分压平衡常数Kp=________MPa(保留一位小数)。
,则该温度下反应Ⅴ的分压平衡常数Kp=________MPa(保留一位小数)。
③若反应在恒温、恒压条件下进行,平衡后反应容器的体积________![]() (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用KI溶液和FeCl3溶液进行如下实验。下列说法中错误的是 ( )

A.实验i发生的反应为:2Fe3++2I-2Fe2++I2
B.黄色溶液中含有Fe2+、Fe3+、Cl-、K+、I-离子
C.实验ⅲ水溶液中c(Fe2+)小于ⅰ中c(Fe2+)
D.若向实验ⅲ所得液体中滴加![]() 溶液,水层红色比实验ⅱ浅
溶液,水层红色比实验ⅱ浅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com