
【题目】碳及其化合物广泛存在于自然界。请回答下列问题:
(1)反应Ⅰ:![]() △H1 平衡常数为K1
△H1 平衡常数为K1
反应Ⅱ:![]() △H2 平衡常数为K2
△H2 平衡常数为K2
不同温度下,K1、K2的值如下表:
| K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
现有反应Ⅲ:![]() ,结合上表数据,反应Ⅲ是________(填“放热”或“吸热”)反应。
,结合上表数据,反应Ⅲ是________(填“放热”或“吸热”)反应。
(2)![]() 催化加氢合成二甲醚是一种
催化加氢合成二甲醚是一种![]() 转化方法,其过程中主要发生下列反应:
转化方法,其过程中主要发生下列反应:
反应Ⅲ:![]() △H3
△H3
反应Ⅳ:![]() △H=-122.5kJ/mol
△H=-122.5kJ/mol
在恒压、![]() 和
和![]() 的起始量一定的条件下,
的起始量一定的条件下,![]() 平衡转化率和平衡时
平衡转化率和平衡时![]() 的选择性随温度的变化如图。
的选择性随温度的变化如图。
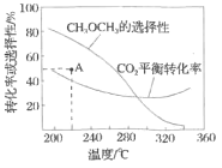
其中:![]() 的选择性
的选择性![]()
①温度高于300℃,![]() 平衡转化率随温度升高而上升的原因是________。
平衡转化率随温度升高而上升的原因是________。
②220℃时,在催化剂作用下![]() 与
与![]() 反应一段时间后,测得
反应一段时间后,测得![]() 的选择性为48%(图中
的选择性为48%(图中![]() 点)。不改变反应时间和温度,一定能提高
点)。不改变反应时间和温度,一定能提高![]() 选择性的措施有________。
选择性的措施有________。
(3)石油化工生产中,利用裂解反应可以获得重要化工原料乙烯、丙烯。一定条件下,正丁烷裂解的主反应如下:
反应Ⅴ:![]()
反应Ⅵ:![]()
一定温度下,向容积为![]() 的密闭容器中通入正丁烷,反应时间
的密闭容器中通入正丁烷,反应时间![]() 与容器内气体总压强
与容器内气体总压强![]() 数据如下:
数据如下:
| 0 | 10 | 20 | 30 | 40 |
| 5 | 7.2 | 8.4 | 8.8 | 8.8 |
①反应速率可以用单位时间内分压的变化表示,即v=![]() ,前
,前![]() 内正丁烷的平均反应速率v(正丁烷)
内正丁烷的平均反应速率v(正丁烷)![]() ________
________![]() ,该温度下,正丁烷的平衡转化率
,该温度下,正丁烷的平衡转化率![]() ________。
________。
②若平衡时乙烯的体积分数为![]() ,则该温度下反应Ⅴ的分压平衡常数Kp=________MPa(保留一位小数)。
,则该温度下反应Ⅴ的分压平衡常数Kp=________MPa(保留一位小数)。
③若反应在恒温、恒压条件下进行,平衡后反应容器的体积________![]() (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。
【答案】吸热 反应Ⅲ的△H>0,温度升高使![]() 转化为
转化为![]() 的平衡转化率上升,反应Ⅳ的
的平衡转化率上升,反应Ⅳ的![]() ,温度升高使
,温度升高使![]() 转化为
转化为![]() 的平衡转化率下降:且上升幅度超过下降幅度 增大压强、使用对反应Ⅳ催化活性更高的催化剂 0.17 76% 2.1 大于
的平衡转化率下降:且上升幅度超过下降幅度 增大压强、使用对反应Ⅳ催化活性更高的催化剂 0.17 76% 2.1 大于
【解析】
判断反应Ⅲ:![]() 的△H时,需利用反应Ⅰ与反应Ⅱ,建立平衡常数与K1、K2的关系,然后分别代入973K和1173K两组数据,得出两个温度下的K,比较确定K随温度的变化,便可确定△H与0的关系。温度高于300℃,
的△H时,需利用反应Ⅰ与反应Ⅱ,建立平衡常数与K1、K2的关系,然后分别代入973K和1173K两组数据,得出两个温度下的K,比较确定K随温度的变化,便可确定△H与0的关系。温度高于300℃,![]() 平衡转化率受反应Ⅲ和反应Ⅳ的影响,两个反应进行综合分析,便可得出
平衡转化率受反应Ⅲ和反应Ⅳ的影响,两个反应进行综合分析,便可得出![]() 平衡转化率随温度升高而上升的原因;分析两个反应前后的气体分子数关系,由此确定一定能提高
平衡转化率随温度升高而上升的原因;分析两个反应前后的气体分子数关系,由此确定一定能提高![]() 选择性的措施;利用三段式,可求出
选择性的措施;利用三段式,可求出![]() 内及平衡时各物质的分压,从而求出速率、转化率及分压平衡常数;由体积不变转化为压强不变时,需关注平衡的移动情况。
内及平衡时各物质的分压,从而求出速率、转化率及分压平衡常数;由体积不变转化为压强不变时,需关注平衡的移动情况。
(1) 反应Ⅲ:![]() ,则K=
,则K=![]() =
=![]() ,由表中数据可以看出,973K时,K<1,1173K时,K>1,温度升高,K值增大,则反应Ⅲ是吸热反应。答案为:吸热;
,由表中数据可以看出,973K时,K<1,1173K时,K>1,温度升高,K值增大,则反应Ⅲ是吸热反应。答案为:吸热;
(2)①反应Ⅲ:![]() △H3<0,
△H3<0,
反应Ⅳ:![]() △H=-122.5kJ/mol
△H=-122.5kJ/mol
升高温度,反应Ⅲ平衡正向移动,![]() 平衡转化率增大,反应Ⅳ平衡逆向移动,
平衡转化率增大,反应Ⅳ平衡逆向移动,![]() 平衡转化率减小,最终结果是
平衡转化率减小,最终结果是![]() 平衡转化率增大,则表明反应Ⅲ对
平衡转化率增大,则表明反应Ⅲ对![]() 平衡转化率的影响占主导地位,从而得出温度高于300℃,
平衡转化率的影响占主导地位,从而得出温度高于300℃,![]() 平衡转化率随温度升高而上升的原因是反应Ⅲ的△H>0,温度升高使
平衡转化率随温度升高而上升的原因是反应Ⅲ的△H>0,温度升高使![]() 转化为
转化为![]() 的平衡转化率上升,反应Ⅳ的
的平衡转化率上升,反应Ⅳ的![]() ,温度升高使
,温度升高使![]() 转化为
转化为![]() 的平衡转化率下降:且上升幅度超过下降幅度。答案为:反应Ⅲ的△H>0,温度升高使
的平衡转化率下降:且上升幅度超过下降幅度。答案为:反应Ⅲ的△H>0,温度升高使![]() 转化为
转化为![]() 的平衡转化率上升,反应Ⅳ的
的平衡转化率上升,反应Ⅳ的![]() ,温度升高使
,温度升高使![]() 转化为
转化为![]() 的平衡转化率下降:且上升幅度超过下降幅度;
的平衡转化率下降:且上升幅度超过下降幅度;
②反应Ⅲ的反应前后气体分子数相等,而反应后气体的分子数减小,要想提高![]() 选择性,即设法促进反应Ⅳ的平衡正向移动,从而得出不改变反应时间和温度,一定能提高
选择性,即设法促进反应Ⅳ的平衡正向移动,从而得出不改变反应时间和温度,一定能提高![]() 选择性的措施有增大压强、使用对反应Ⅳ催化活性更高的催化剂。答案为:增大压强、使用对反应Ⅳ催化活性更高的催化剂;
选择性的措施有增大压强、使用对反应Ⅳ催化活性更高的催化剂。答案为:增大压强、使用对反应Ⅳ催化活性更高的催化剂;
(3)①前![]() 时,混合气的总压强为8.4MPa,设正丁烷的变化量为x,则三段式为:
时,混合气的总压强为8.4MPa,设正丁烷的变化量为x,则三段式为:
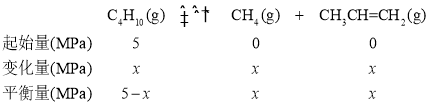
5MPa-x+x+x=8.4MPa,x=3.4MPa,前![]() 内正丁烷的平均反应速率v(正丁烷)
内正丁烷的平均反应速率v(正丁烷)![]()
![]() 0.17
0.17![]() 。
。
平衡时,混合气的总压强为8.8MPa,设正丁烷的变化量为y,则三段式为:
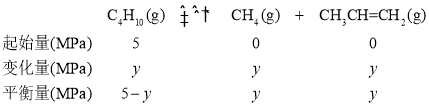
5MPa-y+y+y=8.8MPa,y=3.8MPa,该温度下,正丁烷的平衡转化率![]()
![]() =76%。答案为:0.17;76%;
=76%。答案为:0.17;76%;
②若平衡时乙烯的体积分数为![]() ,则平衡时p(C2H4)= p(C2H6)=8.8MPa×
,则平衡时p(C2H4)= p(C2H6)=8.8MPa×![]() =2.2MPa,发生反应后,压强由5MPa变为8.8MPa,压强增大3.8MPa,发生反应Ⅵ,压强增大2.2MPa,则发生反应Ⅴ,压强增大3.8MPa-2.2MPa=1.6MPa,从而得出平衡时p(CH4)= p(C3H6)= 1.6MPa,p(C4H10)= 5MPa-3.8MPa=1.2MPa,该温度下反应Ⅴ的分压平衡常数Kp=
=2.2MPa,发生反应后,压强由5MPa变为8.8MPa,压强增大3.8MPa,发生反应Ⅵ,压强增大2.2MPa,则发生反应Ⅴ,压强增大3.8MPa-2.2MPa=1.6MPa,从而得出平衡时p(CH4)= p(C3H6)= 1.6MPa,p(C4H10)= 5MPa-3.8MPa=1.2MPa,该温度下反应Ⅴ的分压平衡常数Kp=![]() = 2.1MPa。答案为:2.1;
= 2.1MPa。答案为:2.1;
③反应在恒温、恒压条件下进行,若平衡不移动,则平衡后反应容器的体积为8.8L,现减压导致平衡向气体分子数增大的方向移动,气体的压强增大,所以还需增大容器的体积,以保证压强不变,从而得出平衡后反应容器的体积大于![]() 。答案为:大于。
。答案为:大于。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】离子液体是一类具有很高应用价值的绿色溶剂和催化剂,其中的EMIM+离子由H、C、N三种元素组成,结构如图所示。回答下列问题:
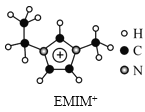
(1)碳原子价层电子的轨道表达式为__,基态碳原子中,核外电子占据的最高能级的电子云轮廓图为__形。
(2)根据价层电子对互斥理论,NH3、NO3-、NO2-中,中心原子价层电子对数不同于其他两种粒子的是__。NH3比PH3的沸点高,原因是__。
(3)氮元素的第一电离能比同周期相邻元素都大的原因是__。
(4)EMIM+离子中,碳原子的杂化轨道类型为__。分子中的大π键可用符号Π![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为Π
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为Π![]() ),则EMIM+离子中的大π键应表示为__。
),则EMIM+离子中的大π键应表示为__。
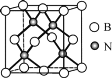
(5)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于__晶体,其中硼原子的配位数为__。已知:立方氮化硼密度为dg/cm3,B原子半径为xpm,N原子半径为ypm,阿伏加德罗常数的值为NA,则该晶胞中原子的空间利用率为__(列出化简后的计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①氯化钡、②金刚石、③氯化铵、④硫酸钠、⑤干冰、⑥碘片六种物质,按下列要求回答:
(1)熔化时不需要破坏化学键的是________,熔化时需要破坏共价键的是________,熔点最高的是________,熔点最低的是________。
(2)属于离子化合物的是________,只有离子键的物质是________,以分子间作用力结合的是________。
(3)①的电子式是____________,⑥的电子式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有浓度均为0.1 mol/L的下列溶液:
①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)___________________________。
(2)④、⑤、⑦、⑧四种溶液中NH4+浓度由大到小的顺序是(填序号)________ 。
(3)将②、③混合后,若溶液呈中性,则消耗两溶液的体积为 ② ________ ③(填“>”、“<”或“=”)溶液中的离子浓度由大到小的顺序为______________________________
(4)常温下将0.010 mol CH3COONa和0.004 mol HCl溶于水,配制成0.5 L混合溶液,判断:
①其中有两种粒子的物质的量之和一定等于0.010 mol,它们是________和________。
②溶液中c(CH3COO-)+n(OH-)-n(H+)=________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置进行如下实验,能达到实验目的的是

A. 瓶中盛满水,从B口进气,用排水法收集HCl气体
B. 瓶中盛适量浓硫酸,从A口进气来干燥NH3
C. 从B口进气,用排空气法收集CO2
D. 瓶中盛满水,A口连导管并伸入量筒中,从B口进气,用排水法测量生成H2的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下用aLpH=3的HX溶液与bLpH=11的氢氧钠溶液相混合,下列叙述正确的( )
A.若两者恰好中和,则一定是a=b
B.若混合液显碱性,则一定是b≥a
C.若混合液显中性,则一定是a≤b
D.若混合液显酸性,则一定是a≥b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里迅速制备少量氯气可利用如下反应:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,此反应不需加热,常温下就可以迅速进行,而且对盐酸的浓度要求不高。
(1)该反应中,氧化剂是________,还原剂是________。
(2)当参加反应的氧化剂的物质的量是1mol时,被氧化的还原剂的物质的量是________,产生的氯气在标准状况下的体积为________,电子转移数目为________。
(3)氯化氢在该反应过程中表现出的化学性质有________。
A 酸性B 还原性C 氧化性D 挥发性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物N具有镇痛、消炎等药理作用,其合成路线如下:
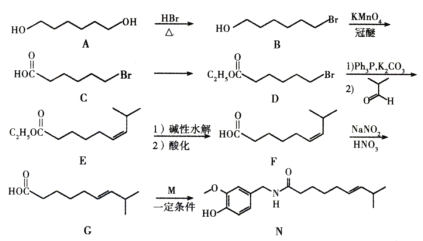
(1)A的系统命名为____________,E中官能团的名称为_____________。
(2)A→B的反应类型为____________,从反应所得液态有机混合物中提纯B的常用方法为_____________。
(3)C→D的的化学方程式为_____________。
(4)C的同分异构体W(不考虑手性异构)可发生银镜反应;且1 mol W最多与2 mol NaOH发生反应,产物之一可被氧化成二元醛。满足上述条件的W有____________种,若W的核磁共振氢谱具有四组峰,则其结构简式为_____________。
(5)参照上述合成路线,以![]() 为原料,采用如下方法制备医药中间体
为原料,采用如下方法制备医药中间体![]() 。
。
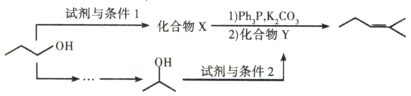
该路线中试剂条件1为____________,X的结构简式为____________;试剂与条件2为____________,Y的结构简式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法错误的是( )
A.乙烯、聚氯乙烯和苯中均含有碳碳双键
B.植物油含不饱和高级脂肪酸酯,能使![]() 的
的![]() 溶液褪色
溶液褪色
C.乙酸乙酯中混有的少量乙酸,可用饱和![]() 溶液除去
溶液除去
D.用酒精消毒,其原理是酒精使细菌中的蛋白质变性而失去生理活性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com